Certaines créatures possèdent des capacités qui semblent relever de la science-fiction. C’est le cas de l’escargot-pomme, dont l’œil peut se régénérer entièrement après avoir été détruit. Une équipe de biologistes y voit une piste fascinante pour un jour, peut-être, réparer la vue humaine.
Un modèle longtemps ignoré

On pourrait s’étonner que ce mollusque aux pouvoirs extraordinaires soit resté si longtemps sous les radars de la biologie régénérative. Après tout, les naturalistes observent depuis le XVIIIe siècle la faculté déconcertante de certains escargots à faire repousser leur tête. Alice Accorsi, professeure à l’université de Californie à Davis, s’est posé la même question : « Je me suis demandé pourquoi personne n’utilisait encore les escargots pour étudier la régénération ».
Le problème, explique-t-elle, tenait au choix de l’espèce. Beaucoup sont difficiles à élever, trop lents ou leur cycle de vie complexifie les expériences. L’escargot-pomme (*Pomacea canaliculata*) est venu changer la donne : résilient, prolifique et facile à maintenir en laboratoire, il est devenu le candidat idéal.
Un œil étonnamment familier
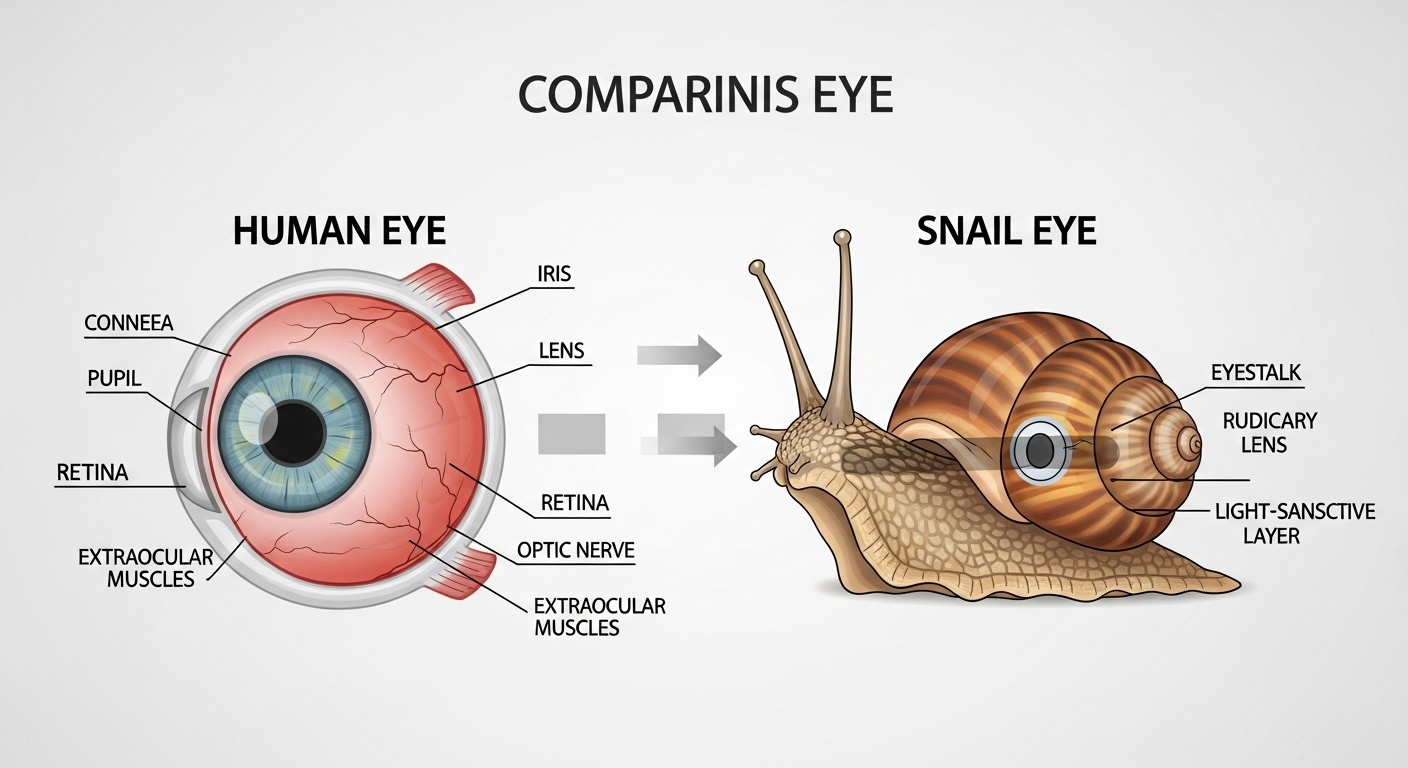
Ce qui rend cet escargot si précieux pour la recherche, ce n’est pas seulement sa résilience. C’est surtout son œil, qui ressemble étrangement au nôtre. Bien qu’étant un invertébré, il possède un œil de type « caméra », une structure complexe dotée d’une cornée, d’un cristallin pour focaliser la lumière et d’une rétine couverte de photorécepteurs. Autant de composants que l’on retrouve dans l’œil humain.
Cette proximité anatomique, et comme on le verra, génétique, en fait un modèle unique. « Jusqu’ici, il nous manquait un système permettant d’examiner la régénération complète de l’œil », souligne la chercheuse. Avec l’escargot-pomme, c’est désormais chose faite.
Un mois pour renaître de sa blessure
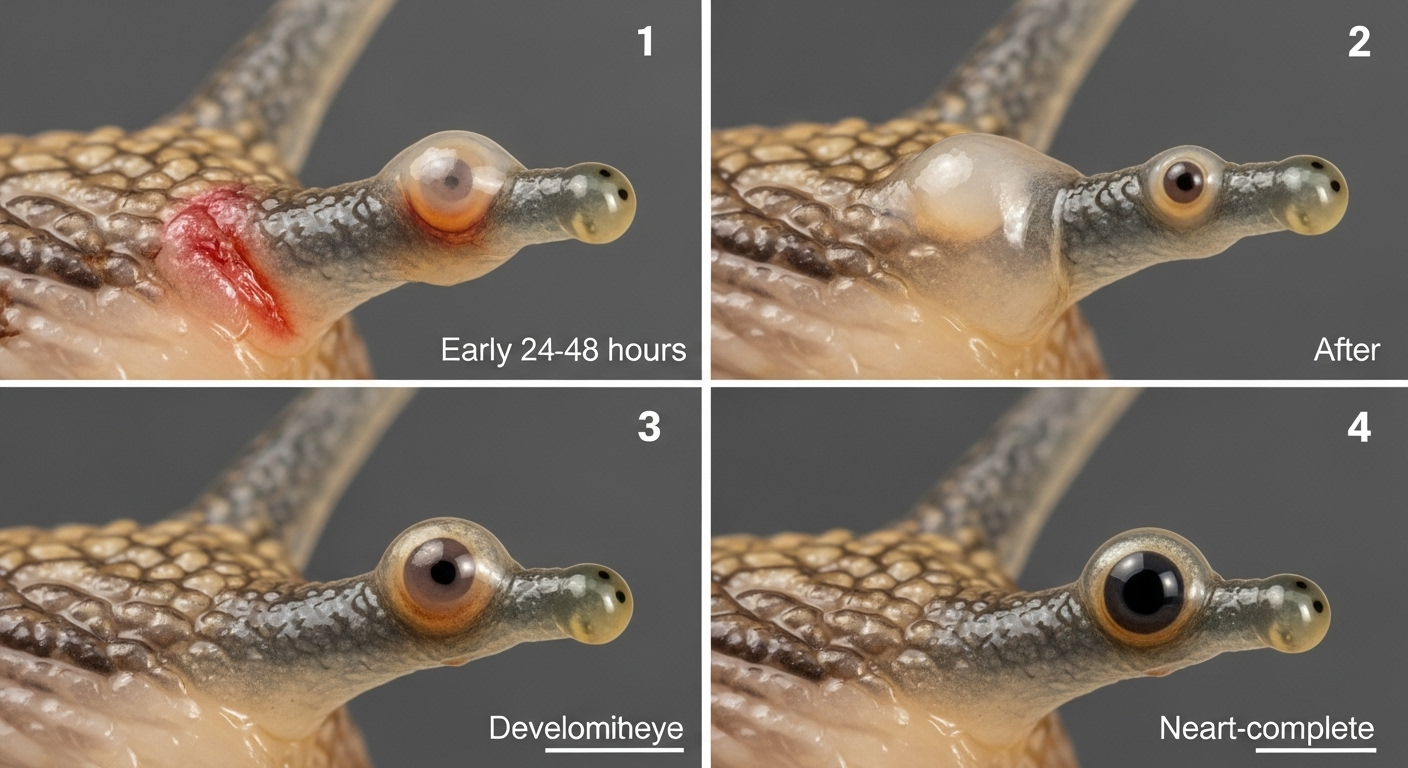
Que se passe-t-il concrètement lorsqu’on ampute l’œil d’un escargot-pomme ? Le processus de reconstruction est un ballet biologique qui dure près d’un mois. Tout commence par une phase de cicatrisation rapide, en 24 heures, pour éviter toute infection. Puis, un amas de cellules indifférenciées, des sortes de cellules souches, se forme sur la zone lésée.
Au bout d’une dizaine de jours, la magie opère. Ces cellules commencent à se spécialiser pour former le cristallin, la rétine, puis le nerf optique. Vers le 28e jour, l’œil est anatomiquement complet. Même si les chercheurs supposent qu’il faut encore du temps pour que la fonction visuelle soit parfaite, la structure, elle, est bien là.
Sur la piste du chef d'orchestre génétique

Mais comment le corps sait-il quoi faire ? La réponse se trouve dans les gènes. Durant la régénération, les chercheurs ont observé que l’expression de près de 9 000 gènes était modifiée. L’enjeu est d’identifier les grands organisateurs de ce processus.
Un suspect principal a vite été identifié : le gène Pax6. Il s’agit d’un gène architecte, connu pour son rôle fondamental dans le développement des yeux et du cerveau chez une myriade d’espèces, de la mouche à l’être humain. Et l’escargot, tout comme nous, en possède deux copies.
La preuve par l'expérimentation
Pour confirmer le rôle de ce « super-gène », l’équipe a utilisé les ciseaux moléculaires CRISPR-Cas9 afin de le désactiver chez des embryons d’escargot. L’idée était simple : si Pax6 est bien le maître d’œuvre du développement oculaire, que se passe-t-il en son absence ?
Le résultat fut sans appel. Les embryons privés de leurs deux copies de Pax6 se sont développés normalement, mais sans yeux. La preuve était faite. La prochaine étape sera de voir si ce même gène est aussi indispensable à la régénération chez l’adulte, et non plus seulement au développement initial.
De l'aquarium au bloc opératoire ?

L’enjeu, désormais, est de taille. L’équipe d’Alice Accorsi espère identifier non pas un seul gène, mais l’ensemble des facteurs qui déclenchent cette formidable capacité de reconstruction. Si ces gènes existent aussi chez les vertébrés, et c’est le cas pour beaucoup, la question devient vertigineuse.
« En théorie, il pourrait devenir possible de les activer chez l’humain pour favoriser une régénération oculaire », conclut-elle. L’idée, à très long terme, serait de réveiller ces mécanismes en sommeil chez nous. Un espoir immense pour des pathologies comme la dégénérescence maculaire, même si le chemin de l’aquarium au patient reste, bien sûr, encore très long.
Selon la source : trustmyscience.com