Le ballet cellulaire qui calme l’inflammation : une découverte majeure pour l’immunité
Auteur: Mathieu Gagnon
Nos gardiens de la paix internes
Le souci, c’est que quand ces cellules ne fonctionnent pas bien, c’est la porte ouverte à des maladies auto-immunes ou des inflammations chroniques. On ne comprenait pas bien, jusqu’à récemment, comment elles s’activaient et se désactivaient. Des chercheurs de l’hôpital St. Jude Children’s Research Hospital viennent de lever le voile sur ce mécanisme complexe, et c’est passionnant.
Le métabolisme, le chef d’orchestre caché
Une fois leur travail terminé, elles ne s’éteignent pas simplement. Non, elles retournent à un état de repos, une sorte de mise en veille. « Cette dernière phase, où elles redeviennent métaboliquement calmes, n’avait jamais été décrite auparavant », explique Jordy Saravia, l’un des auteurs de l’étude. C’est peut-être la clé pour comprendre comment ces cellules savent quand leur mission est terminée. C’est une véritable feuille de route pour de futures thérapies.
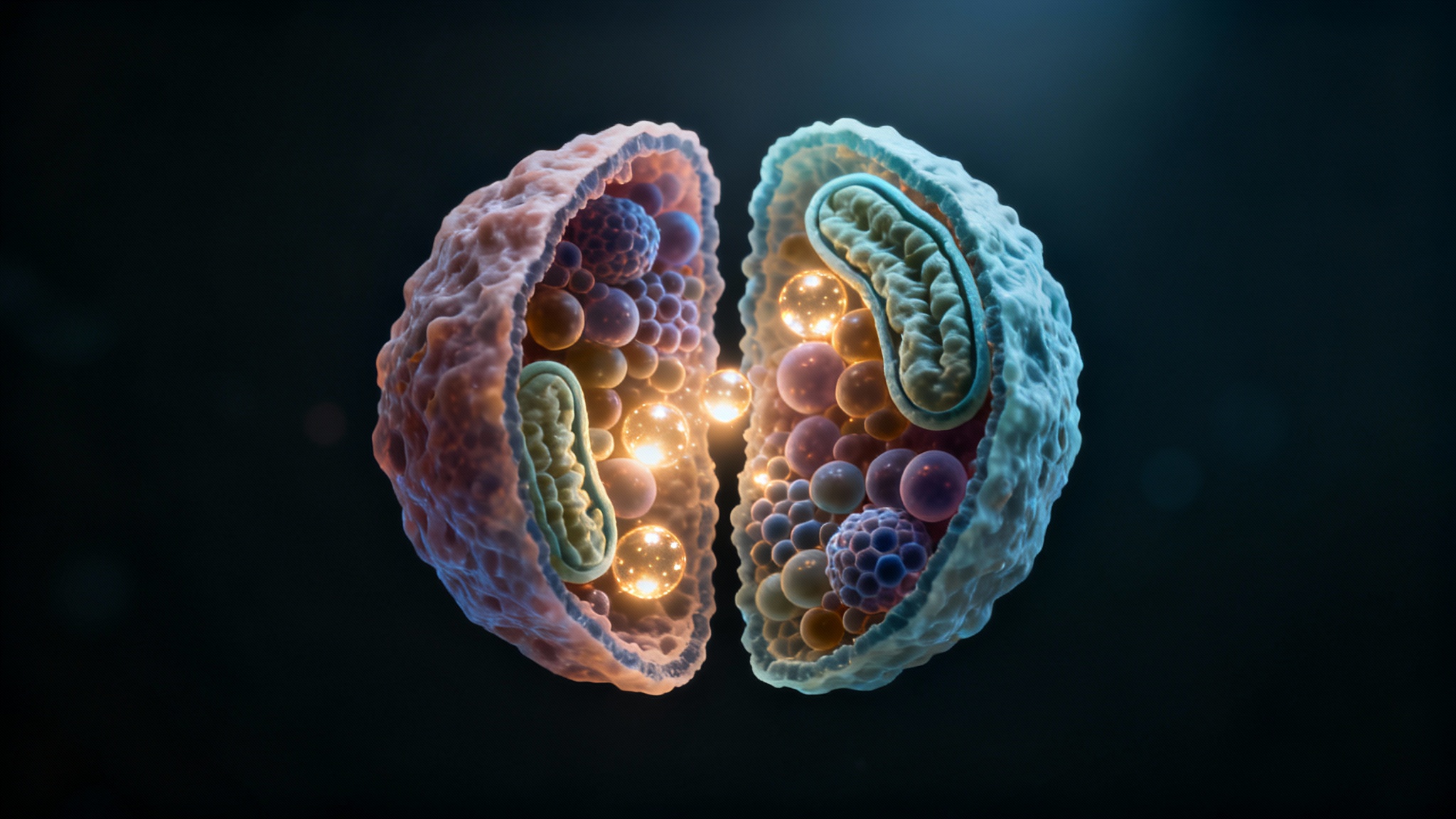
Une histoire de deux organites : les centrales et les recycleurs
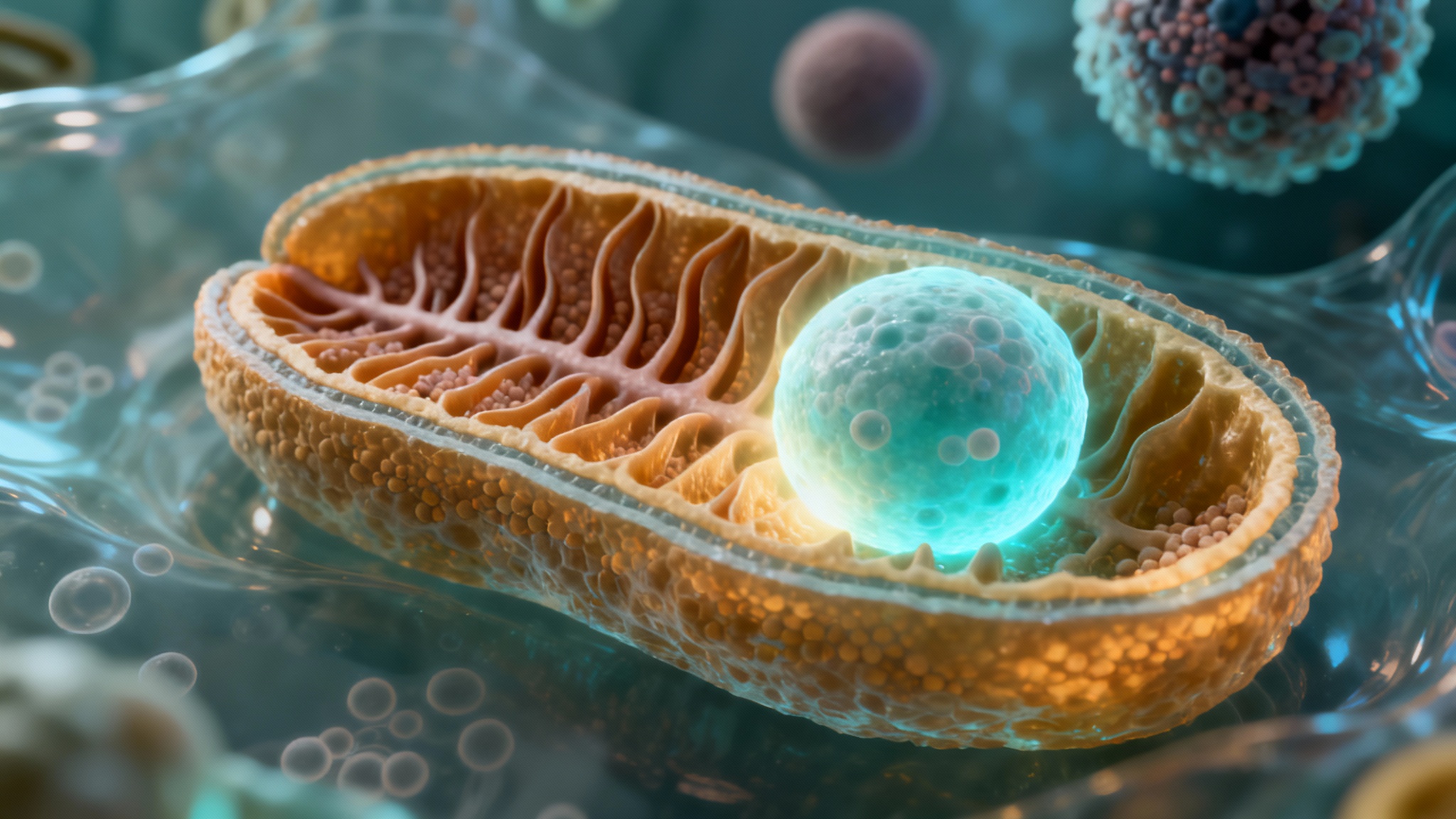
En regardant au microscope électronique, les chercheurs ont vu que les cellules les plus actives avaient beaucoup plus de mitochondries, et que celles-ci étaient plus performantes, avec plus de ‘plis’ internes. C’est comme avoir plus de générateurs dans chaque centrale. Quand ils ont bloqué le gène responsable de ces plis (un gène appelé Opa1), les lysosomes se sont mis à travailler davantage pour compenser. Mais cela n’a pas suffi. La cellule était moins efficace. Ça montre à quel point ces deux systèmes sont liés.
Quand les organites se parlent : une communication inattendue
En fait, que l’on touche aux mitochondries (avec Opa1) ou aux lysosomes (avec Flcn), le résultat est le même : un signal est mal transmis à une protéine chef d’orchestre appelée TFEB. C’est la preuve d’une communication complexe. « Nous sommes les premiers à décortiquer ce dialogue entre organites dans les lymphocytes T régulateurs », précise Jordy Saravia. C’est cette communication qui assure le bon fonctionnement de nos gardiens de la paix.
Une découverte surprenante : de nouvelles pistes contre le cancer
L’idée a donc germé : et si on bloquait ce gène pour affaiblir les défenses de la tumeur ? Ils ont testé sur des souris, et ça a marché. En supprimant Flcn, les défenses immunitaires anti-tumorales sont devenues plus efficaces, et les tumeurs ont diminué de taille. Cela pourrait ouvrir la voie à de nouvelles stratégies pour améliorer les immunothérapies actuelles contre le cancer. C’est une piste vraiment prometteuse.
Conclusion : ce que cela change pour nous

Cette danse délicate entre les mitochondries et les lysosomes n’est pas qu’une belle histoire de biologie. Elle nous donne des clés concrètes pour agir. Demain, on pourrait peut-être développer des traitements pour mieux contrôler l’inflammation dans les maladies auto-immunes ou, à l’inverse, pour empêcher les tumeurs de se protéger de nos défenses. Comme le dit le Dr Hongbo Chi, qui a dirigé l’étude, ces nouvelles connaissances « aideront à améliorer les traitements des maladies auto-immunes et du cancer ».
