L’herpès labial (bouton de fièvre) lié au risque d’Alzheimer : une nouvelle perspective sur la protéine Tau
Auteur: Mathieu Gagnon
Mais, franchement, les choses sont rarement aussi simples en biologie, n’est-ce pas? Récemment, des chercheurs de l’Université de Pittsburgh (Pitt) ont fait une découverte inattendue qui vient bousculer ce schéma. Ils ont trouvé un lien étonnant entre la maladie d’Alzheimer, ces fameuses protéines Tau, et le virus de l’herpès simplex-1 (HSV-1), celui qui provoque les boutons de fièvre. Ça change la perspective qu’on avait sur cette maladie, et ça, c’est passionnant!
Le rôle surprenant de la protéine Tau : défenseur avant d'être destructeur
Cependant, cette nouvelle étude vient contredire cette vision trop simpliste. Le Dr Or Shemesh, l’auteur principal de la recherche, explique que leur travail « remet en question l’idée conventionnelle selon laquelle Tau est uniquement nocive ». Il suggère que p-tau pourrait initialement faire partie du système de défense immunitaire du cerveau. Imaginez: elle n’est pas l’ennemi au départ, mais un premier intervenant. Cette idée, si elle se confirme, nous offre une nouvelle façon de cibler les thérapies.
Les routes cellulaires sous la menace virale

La grande question que l’équipe de Pitt s’est posée était la suivante : est-ce que la p-tau agit en tant que premier répondant immédiat lorsque l’HSV-1 se réactive, au lieu d’être simplement un indicateur tardif de déclin? Ils ont donc cherché à savoir si des traces d’HSV-1 étaient présentes dans le cerveau des personnes atteintes d’Alzheimer et comment ces traces se liaient à Tau et à l’amyloïde.
La chasse aux indices viraux : agrandir le minuscule
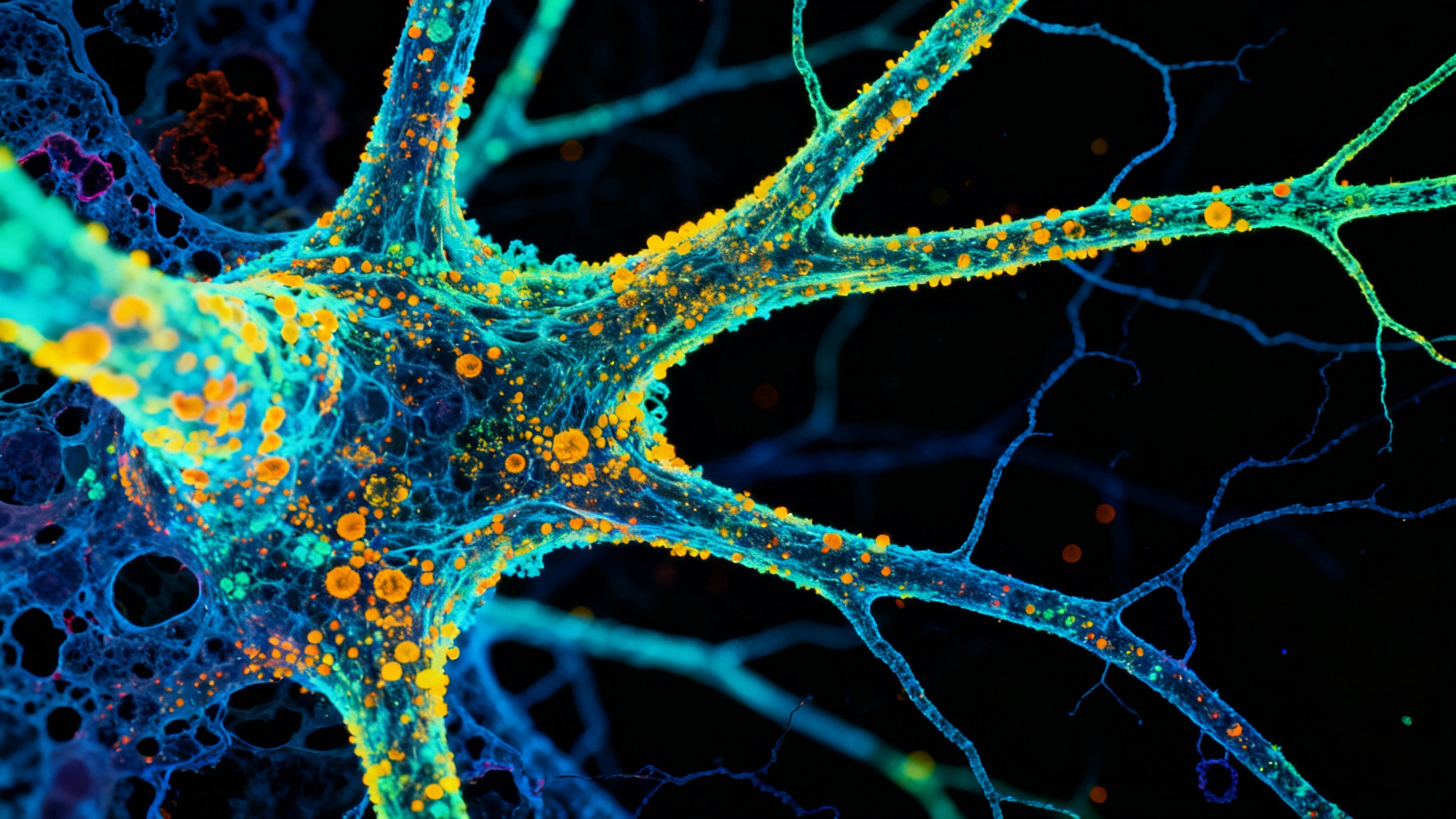
Mais le plus intéressant, c’est peut-être l’« expansion pathologique ». C’est une technique géniale : ils font gonfler le tissu cérébral préservé jusqu’à environ quatre fois et demie sa taille d’origine. Quand l’échantillon grossit de manière uniforme, les molécules, normalement ultra-serrées, s’écartent. Cela permet aux marqueurs moléculaires de se glisser plus facilement pour marquer les cibles comme Tau ou les protéines virales. Le résultat? Une vue d’une clarté incroyable, presque nanoscopique, sur ce qui se passe réellement dans une tranche de cerveau malade.
L’ICP27 : le témoin d’une réactivation en cours
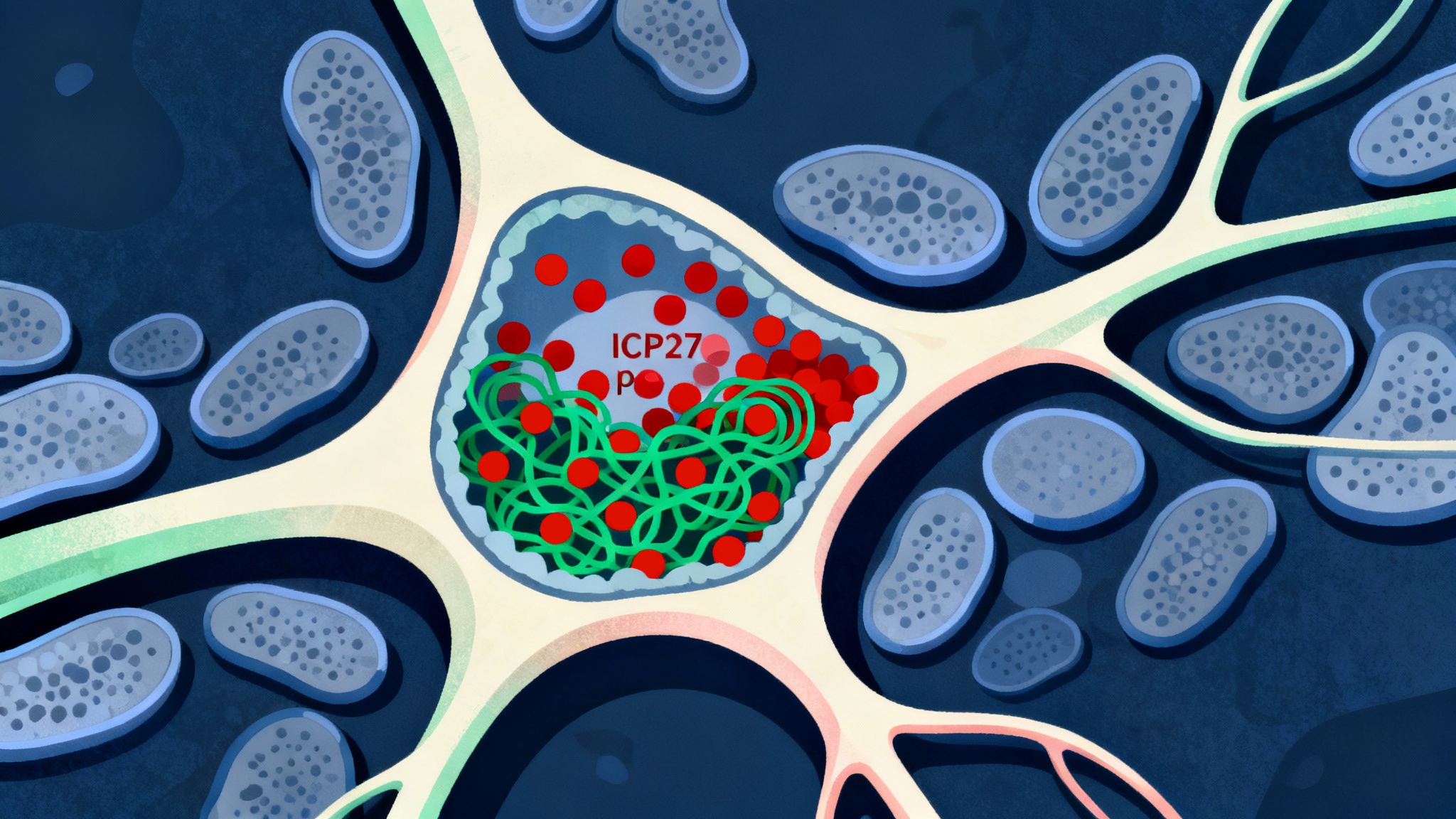
Au début de la maladie, l’ICP27 était surtout détectée dans les neurones des régions fortement touchées par Alzheimer (comme l’hippocampe). Plus tard, la protéine migrait vers les microglies, les cellules immunitaires résidentes du cerveau. Ce qui est crucial, c’est que les zones riches en ICP27 chevauchaient étroitement les zones riches en Tau phosphorylée. Cependant, et c’est très important, cette corrélation ne s’étendait pas aux plaques amyloïdes. Le virus et l’amyloïde ne semblaient pas être dans la même équipe.
Les « mini-cerveaux » révèlent une protection initiale

Qu’ont-ils trouvé? Lorsque les chercheurs infectaient ces mini-cerveaux avec l’HSV-1, la phosphorylation de Tau augmentait. Logique, non? Mais ce qui est surprenant, c’est ce qui s’est passé quand ils ont testé l’inverse : qu’arrive-t-il au virus si on augmente artificiellement la p-tau?
Dans les cultures sans p-tau élevée, environ les deux tiers des neurones mouraient après l’infection. Mais, quand la p-tau était augmentée expérimentalement, les niveaux d’ICP27 chutaient, et les neurones survivaient à l’infection à des taux beaucoup plus élevés. Finalement, seule une petite fraction mourrait. Cela suggère fortement que la p-tau pourrait être, au début, une réponse protectrice face au stress viral.
Quand la protection devient une maladie chronique

Le problème survient si cette réponse est déclenchée trop souvent ou dure trop longtemps. Cette même modification protectrice peut alors basculer, mal se replier, former des agrégats et créer les fameuses dégénérescences. La protection de courte durée, si elle reste activée de manière chronique, se transforme en auto-destruction.
Cette recherche ne dit pas que l’HSV-1 est la cause unique de l’Alzheimer, mais qu’il interagit fortement avec elle. C’est une piste précieuse qui ouvre de nouvelles voies de thérapie, peut-être en calmant l’activité virale ou en ajustant ces signaux d’alarme cellulaires. Le Dr Shemesh et son équipe ont bien l’intention de continuer à explorer ces mécanismes complexes dans leurs prochaines études, publiées dans le journal Cell Reports. C’est assurément une affaire à suivre de très près.
Selon la source : earth.com