Cancer du sang : quand l’effondrement de l’architecture ADN trahit nos cellules
Auteur: Mathieu Gagnon
Au-delà du code, la structure
Pendant des décennies, nous avons imaginé le cancer comme une simple faute de frappe dans le grand livre de la vie, une erreur de séquence dans notre code génétique qui provoquerait le chaos. C’est une vision que nous partageons tous, je suppose, car elle est simple à comprendre : une mutation survient, et la maladie s’installe. Pourtant, une étude fascinante présentée lors de la réunion annuelle de la Société américaine d’hématologie (ASH) en 2025 vient bousculer cette certitude en nous invitant à voir les choses autrement. Imaginez un instant une métropole parfaitement organisée où, soudainement, les routes disparaissent, coupant des quartiers entiers des services d’urgence ou de l’électricité. Ce n’est pas que les bâtiments ont changé, c’est que la structure même de la ville s’est effondrée. C’est exactement ce qui se produit au cœur de nos cellules lorsque l’architecture tridimensionnelle de l’ADN cède. Ce n’est plus une question de texte, mais de forme, de repliement, et c’est une perspective qui, à mon sens, change radicalement notre compréhension de la biologie cellulaire.
Cette découverte majeure nous vient du Sylvester Comprehensive Cancer Center de l’Université de Miami, où le Dr Martin Rivas et son équipe ont mis en lumière un concept novateur : la « suppression tumorale architecturale ». Jusqu’ici, nous étions peut-être trop focalisés sur la liste des ingrédients génétiques sans prêter attention à la manière dont ils étaient rangés dans le placard exigu du noyau cellulaire. L’étude révèle que même des perturbations subtiles dans la manière dont notre génome s’organise dans l’espace peuvent prédisposer un individu au lymphome. C’est un constat à la fois effrayant et porteur d’espoir, car il suggère que le cancer du sang ne naît pas uniquement de gènes cassés, mais d’une perte de plan, d’un échafaudage qui s’écroule silencieusement. En observant ces mécanismes, on réalise que la nature est d’une complexité vertigineuse, où la géométrie de nos molécules est tout aussi vitale que leur composition chimique pure.
Les architectes invisibles de nos cellules
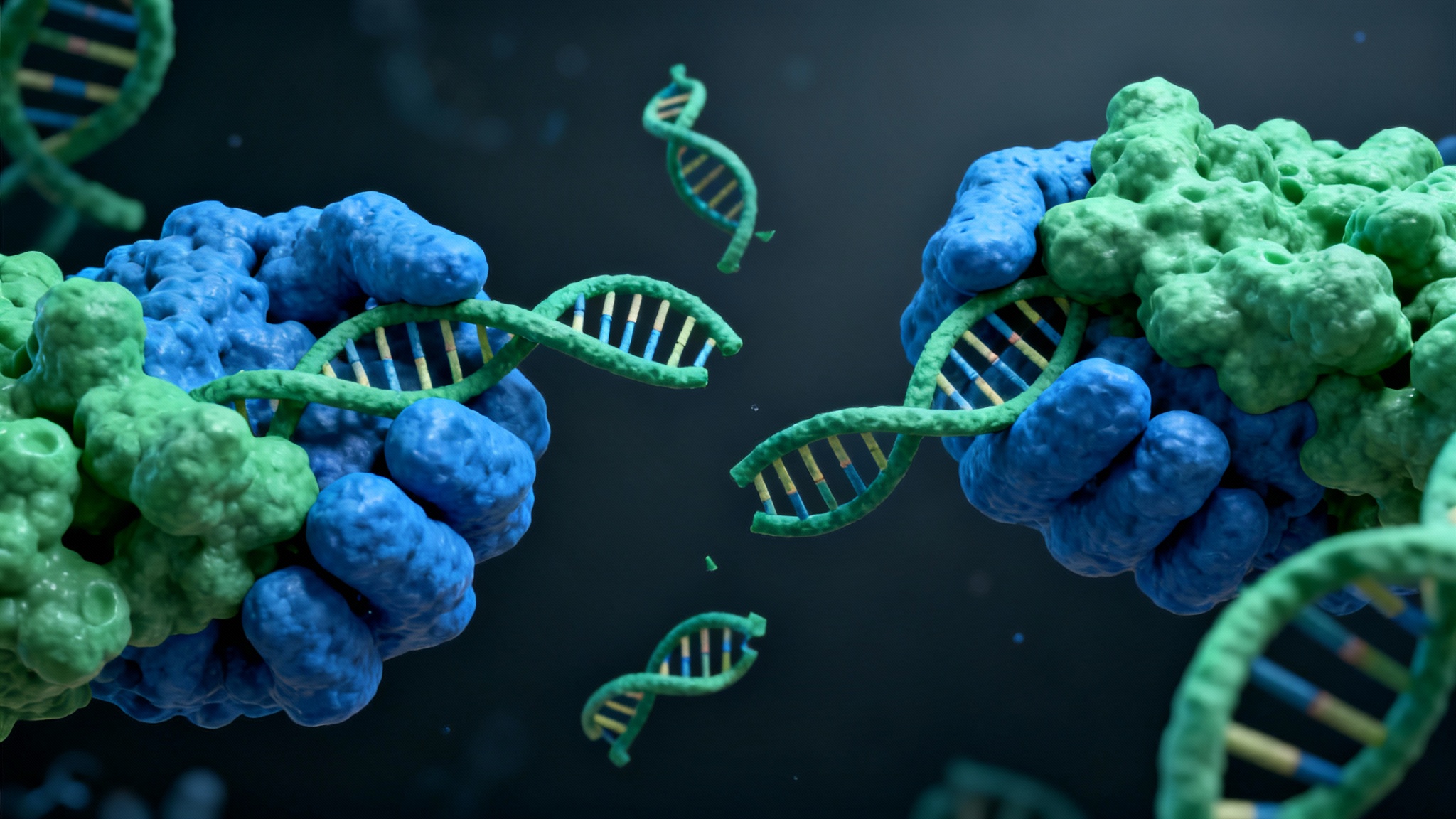
Pour bien saisir la portée de ces travaux, il faut s’intéresser aux ouvriers invisibles qui maintiennent la structure de notre ADN : des protéines nommées SMC3 et CTCF. Considérez-les comme les agrafes ou les piliers qui permettent à l’ADN de former des boucles précises. Ces boucles ne sont pas là pour faire joli ; elles sont fonctionnelles, agissant comme des câbles électriques reliant un interrupteur (que les scientifiques appellent un « enhancer ») à l’ampoule qu’il doit allumer (le gène). L’étude du Dr Rivas montre qu’il suffit de perdre seulement la moitié de ces protéines – un phénomène appelé haploinsuffisance – pour que le système commence à dérailler. Ce n’est pas une destruction totale, non, c’est plus insidieux. Les boucles à courte portée disparaissent, le contact entre l’interrupteur et le gène est rompu, et des gènes suppresseurs de tumeurs cruciaux se retrouvent réduits au silence, faute de signal d’activation.
Les conséquences biologiques de cette défaillance architecturale sont dramatiques pour le destin des cellules immunitaires, en particulier les lymphocytes B. Normalement, ces cellules suivent un parcours de maturation rigoureux pour devenir des plasmocytes, ces usines à anticorps qui nous protègent. Mais sans ces boucles d’ADN intactes, les cellules se heurtent à ce que les chercheurs décrivent comme un « goulot d’étranglement décisionnel ». Incapables d’accéder aux instructions nécessaires pour mûrir correctement, elles restent bloquées dans un état intermédiaire, vulnérable et instable. C’est dans ce terreau fertile, créé par une simple erreur de pliage moléculaire, que la malignité peut prendre racine. Il est troublant de penser que la différence entre une cellule saine et un cancer agressif peut tenir à la simple proximité physique de deux segments d’ADN qui, soudainement, ne se touchent plus.
L’intelligence artificielle comme microscope structurel

Ce qui rend cette découverte particulièrement remarquable, c’est qu’elle aurait été pratiquement impossible sans l’apport massif de l’intelligence artificielle. Le volume de données nécessaire pour cartographier la position de chaque gène dans l’espace tridimensionnel est, pour l’esprit humain, absolument inconcevable. L’équipe de recherche a dû s’appuyer sur des outils analytiques pilotés par l’IA pour interpréter des cartes « Hi-C » complexes, couplées au séquençage d’ARN cellule par cellule. C’est un peu comme essayer de reconstruire le plan complet d’un bâtiment effondré uniquement à partir de photos des débris : l’IA a permis de voir des motifs invisibles à l’œil nu. Elle a révélé comment la perte d’une seule copie d’un gène architectural érode spécifiquement les boucles protégeant des gènes suppresseurs de tumeurs comme Tet2, Kmt2d et Dusp4, validant ainsi une hypothèse d’une complexité inouïe.
Mais ne nous y trompons pas, il ne s’agit pas seulement de théorie fondamentale confinée aux laboratoires de recherche. Les implications pour les patients sont bien réelles et immédiates. L’étude a établi une corrélation directe et inquiétante : les patients atteints de lymphome diffus à grandes cellules B (DLBCL) qui présentent une faible expression de la protéine SMC3 ont un pronostic nettement plus sombre. Cela signifie que l’architecture du génome pourrait devenir, dans un avenir proche, un biomarqueur essentiel pour prédire l’évolution de la maladie. Plus qu’une simple observation, c’est une piste qui s’ouvre : si nous savons que le problème est structurel, peut-être pourrons-nous un jour traiter le cancer non plus en essayant de tuer les cellules, mais en réparant leur échafaudage interne. L’IA nous a donné les lunettes pour voir le problème ; à nous maintenant de construire les outils pour le réparer.
Rebâtir la ville intérieure

Nous entrons, semble-t-il, dans une nouvelle ère de l’oncologie, une ère où la biologie computationnelle et la génétique structurelle convergent pour redéfinir notre approche de la maladie. Comme le souligne avec justesse le Dr Rivas, nous assistons à un changement de paradigme : le traitement du cancer pourrait bientôt consister à restaurer l’architecture cellulaire plutôt qu’à simplement corriger des gènes défectueux. C’est une nuance de taille. Cela revient à dire que pour sauver la ville en ruine, il ne suffit pas de repeindre les façades ou de changer les serrures, il faut consolider les fondations et rétablir les ponts effondrés. Cette vision structurelle offre un nouvel horizon thérapeutique, explorant des médicaments capables de stabiliser la chromatine ou de mimer les boucles d’ADN manquantes, une frontière qui semblait encore relever de la science-fiction il y a quelques années.
Pour conclure, revenons à cette image de la ville isolée. Lorsque les connexions disparaissent, la vie s’arrête et le chaos s’installe. Au plus profond de nos cellules, c’est la même tragédie silencieuse qui se joue lorsque les boucles d’ADN se défont : les gènes protecteurs perdent leur ligne de vie, laissant la porte ouverte à l’anarchie cellulaire. Comprendre que la forme est aussi importante que le fond est une leçon d’humilité pour la science moderne. Si nous parvenons à rétablir ces connexions vitales, à redessiner les plans de notre architecture intérieure, nous pourrions bien tenir entre nos mains la clé pour garder nos cellules — et par extension, nous-mêmes — en vie et en bonne santé face à des maladies jusqu’ici implacables.
Ce contenu a été créé avec l’aide de l’IA.