L’impasse thérapeutique brisée par la génétique

La leucémie aiguë lymphoblastique à cellules T (LAL-T) est l’une des formes de cancer du sang les plus agressives. Lorsque la chimiothérapie ou une greffe de moelle osseuse échouent, les médecins se retrouvent souvent désarmés, confrontés à une maladie dite réfractaire. C’est dans ce contexte d’urgence que la science médicale vient d’apporter une lueur décisive.
Des chercheurs basés à Londres ont dévoilé les résultats spectaculaires d’une thérapie génique inédite, utilisant l’édition de bases de l’ADN pour transformer le traitement des cas jugés incurables. Publiés dans le prestigieux New England Journal of Medicine, ces travaux ouvrent une perspective inattendue : sur onze patients dans une situation désespérée, neuf ont obtenu une rémission complète. Cela pourrait bien redessiner l’avenir de la lutte contre ces cancers.
Le passage aux « médicaments vivants »
Le protocole, fruit d’une collaboration entre l’University College London (UCL) et l’hôpital Great Ormond Street, marque un changement de paradigme. Face à ces formes de leucémie qui se montrent souvent insensibles aux protocoles standards, les scientifiques ont choisi d’abandonner l’approche chimique pour privilégier des « médicaments vivants » : des globules blancs du donneur, méticuleusement modifiés, sont chargés de traquer les cellules cancéreuses.
L’idée est simple dans son concept, mais complexe dans sa réalisation : au lieu d’inonder le corps de toxines, on reprogramme le système immunitaire pour qu’il devienne son propre chasseur de cellules malignes. C’est une riposte ciblée et sur-mesure, là où les traitements classiques n’offraient plus aucune prise.
L’outil de précision : l’édition de bases de l’ADN

L’avancée repose sur une technologie de pointe nommée « base editing ». Contrairement aux outils génomiques plus anciens, cette méthode permet de corriger ou de moduler des segments d’ADN avec une précision extrême. Les chercheurs ont utilisé cette technique pour sculpter des cellules T saines provenant de donneurs.
Ce travail de modélisation confère aux cellules la capacité d’identifier et d’éliminer spécifiquement les lymphocytes T pathologiques. Il est crucial que ces cellules modifiées ne s’attaquent ni à l’organisme du patient (l’hôte), ni à leurs propres congénères, ce qui nécessite une ingénierie génétique complexe en amont.
Une quadruple modification pour une action ciblée
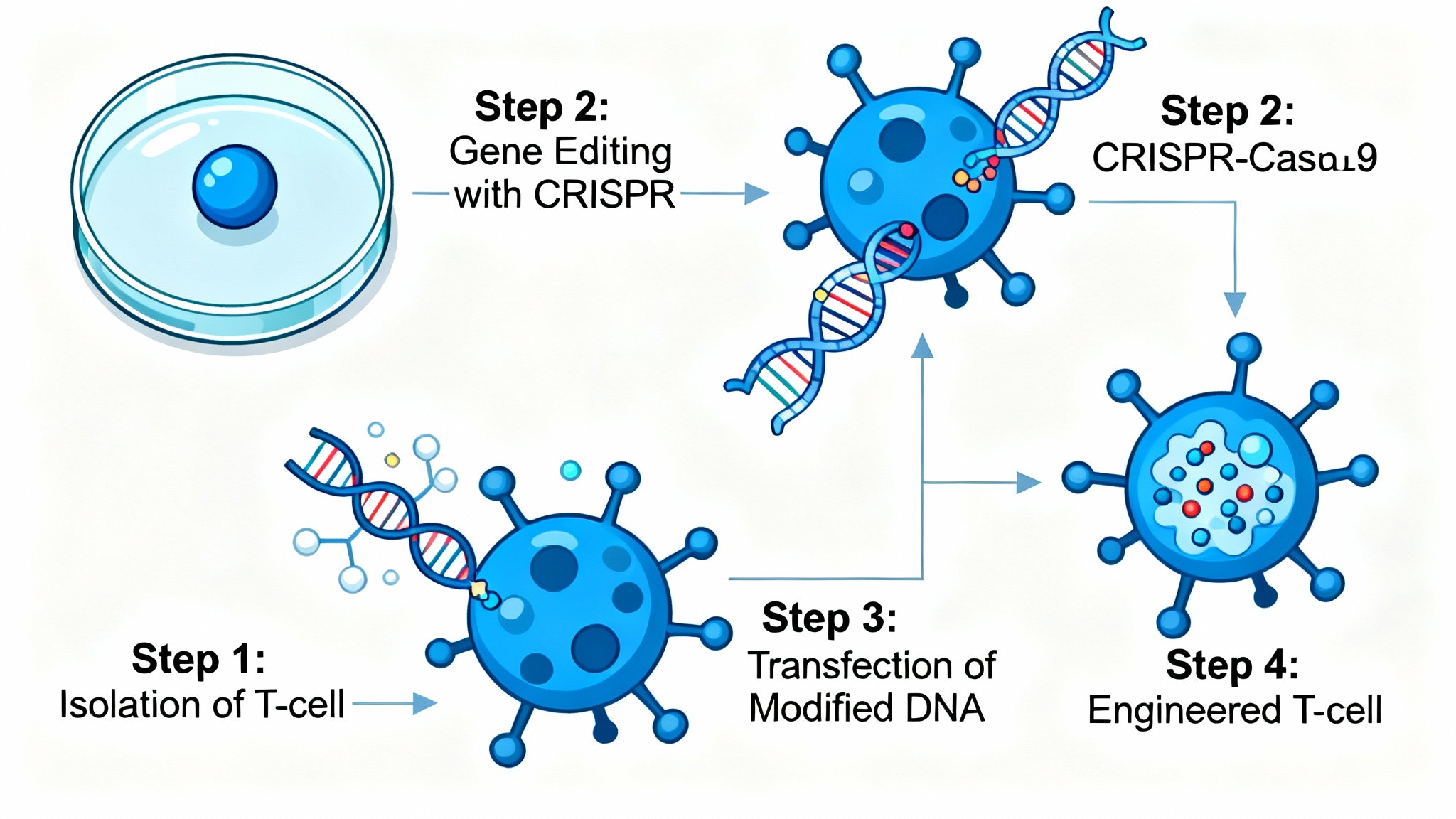
Pour garantir l’efficacité et la sécurité du traitement, le protocole exige plusieurs interventions génétiques successives, chacune étant vitale. La première modification neutralise le mécanisme de reconnaissance initial pour s’assurer que le corps du receveur n’entraîne pas un rejet immédiat des cellules du donneur.
Une seconde modification cruciale consiste à retirer la molécule CD7, partagée par toutes les cellules T, ce qui évite un phénomène d’auto-élimination des cellules thérapeutiques elles-mêmes. Ensuite, une protection est ajoutée pour rendre ces cellules insensibles à la chimiothérapie qui sera administrée. Enfin, et c’est le point essentiel, les cellules sont programmées pour éradiquer toute cellule arborant la signature CD7, ciblant ainsi sans distinction les cellules T saines et malades, afin d’assurer l’éradication complète du cancer.
Des rémissions encourageantes malgré des risques élevés

La procédure clinique est exigeante. Après la suppression totale du système immunitaire du patient par chimiothérapie – une étape nécessaire mais qui l’expose gravement aux infections opportunistes –, les cellules reprogrammées sont transfusées. Si la maladie devient indécelable au bout d’un mois, une greffe de moelle osseuse est alors réalisée pour restaurer l’immunité.
Les résultats sont indéniablement porteurs d’espoir : neuf des onze patients de l’essai sont passés en rémission et ont pu bénéficier de la greffe. Sept d’entre eux demeuraient sans signe de cancer lors du dernier suivi, dont la durée variait entre trois mois et trois ans. Toutefois, deux cas ont montré la capacité de la leucémie à contourner le traitement en perdant la cible CD7, s’échappant ainsi à l’éradication. Les médecins restent donc prudents face à la résilience de la maladie.
Du laboratoire à la vie normale

Ce succès n’est pas qu’une statistique. Il s’incarne par des patients comme Alyssa, la première adolescente de seize ans à avoir bénéficié de cette thérapie à un stade avancé. Elle mène aujourd’hui une vie normale et nourrit même des ambitions scientifiques. Son histoire rappelle que ce qui relevait autrefois de la fiction médicale appartient désormais au champ du possible clinique.
Les équipes de recherche entendent maintenant étendre cette stratégie révolutionnaire d’édition de bases à d’autres formes de cancers hématologiques. Si les défis restent importants, notamment la gestion des risques infectieux et l’adaptation tumorale, cette percée ouvre incontestablement un nouveau chapitre, plein de promesses, dans la lutte contre les cancers du sang jugés jusqu’ici incurables.
Ce contenu a été créé avec l’aide de l’IA.