Un nouvel anticorps capable de s’infiltrer dans les reins pour stopper la maladie polykystique
Auteur: Mathieu Gagnon
Une lueur d’espoir venue de Californie

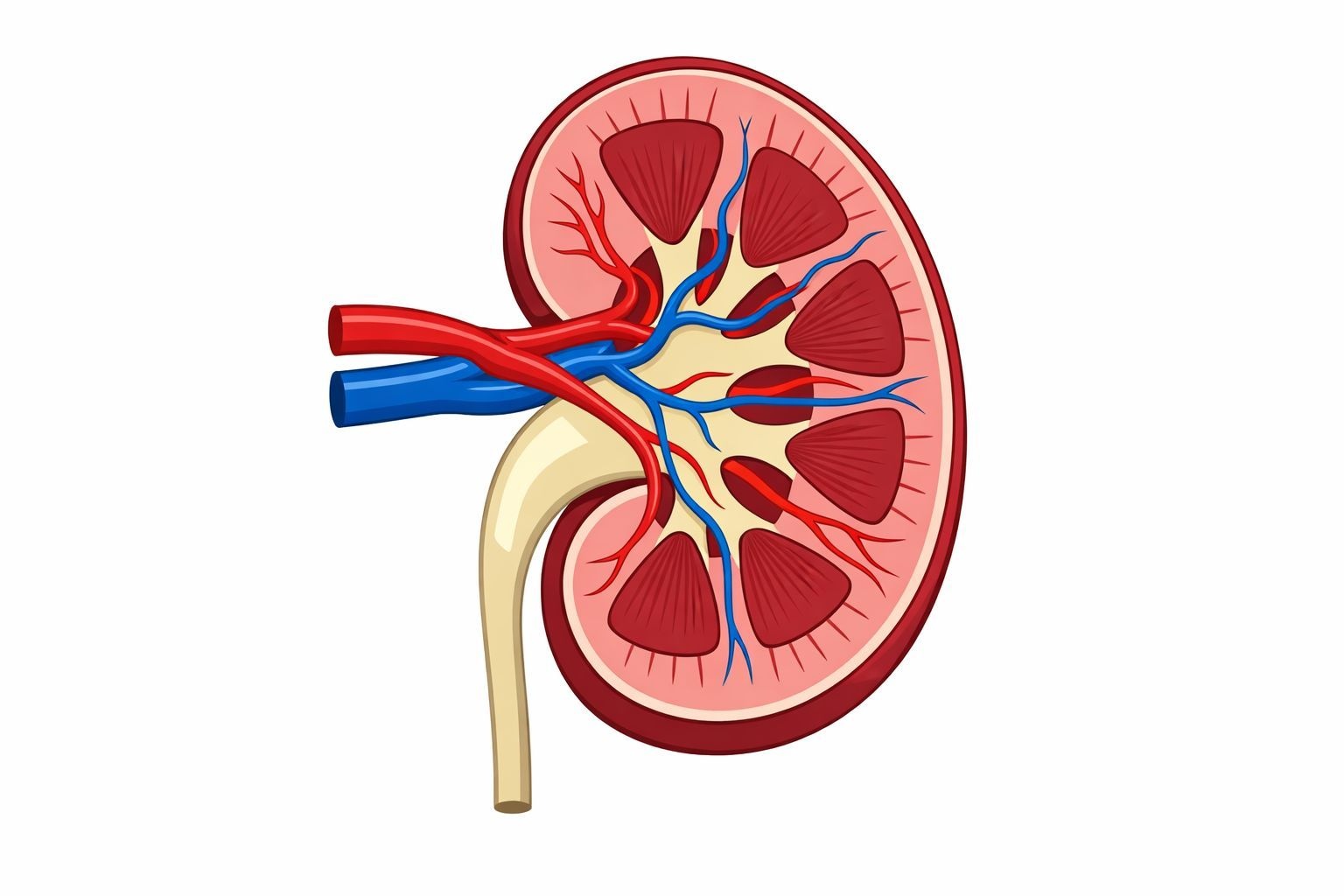
C’est une nouvelle qui, je l’espère, mettra du baume au cœur à bien des familles. Des scientifiques de l’Université de Californie à Santa Barbara (UCSB) viennent de franchir une étape cruciale — et le mot est faible — pour freiner la croissance incessante des kystes qui caractérisent la maladie polykystique des reins (PKD). Pour ceux qui ne connaissent pas cette pathologie héréditaire, c’est un véritable calvaire : des grappes de sacs remplis de liquide envahissent peu à peu les reins. Ça fait mal, terriblement mal parfois, et ça finit souvent par empêcher l’organe de fonctionner, obligeant les patients à passer par la case dialyse. À l’heure actuelle, il n’y a malheureusement aucun remède miracle.
Mais voilà que Sonia Fernandez rapportait, ce 12 décembre 2025, une avancée fascinante. L’équipe cherche à utiliser des anticorps monoclonaux très spécifiques pour aller, littéralement, couper le sifflet aux signaux qui font grossir ces kystes. Thomas Weimbs, le biologiste principal de l’étude publiée dans Cell Reports Medicine, résume la situation avec une simplicité désarmante : « Les kystes continuent de croître indéfiniment. Et nous voulons les arrêter. » L’idée est donc d’introduire un médicament directement à l’intérieur de ces sacs pour stopper la machine infernale. C’est audacieux, non ?
Pourquoi les traitements actuels ne suffisent pas
On pourrait se demander… pourquoi n’y a-t-on pas pensé plus tôt ? Eh bien, c’est compliqué. Il existe bien quelques médicaments à « petites molécules » qui ralentissent un peu les choses, mais comme le souligne Weimbs, le seul traitement disponible aujourd’hui a tendance à provoquer des effets secondaires assez lourds sur les tissus rénaux sains. C’est un peu comme utiliser un marteau pour écraser une mouche, ça fait des dégâts autour. Les anticorps fabriqués en labo sont plus précis, certes, mais le type le plus courant, l’immunoglobuline G (ou IgG pour les intimes), est tout simplement trop gros. C’est bête, hein ?
« Ils sont très efficaces pour le traitement du cancer », admet Weimbs, « mais les anticorps IgG ne traversent jamais les couches cellulaires et ne peuvent jamais pénétrer à l’intérieur des kystes. » Et c’est là tout le problème, car c’est précisément à l’intérieur de ces poches, tapissées de cellules épithéliales, que tout se joue. Si le médicament reste à la porte, il ne sert pas à grand-chose.
Le cercle vicieux de la croissance des kystes
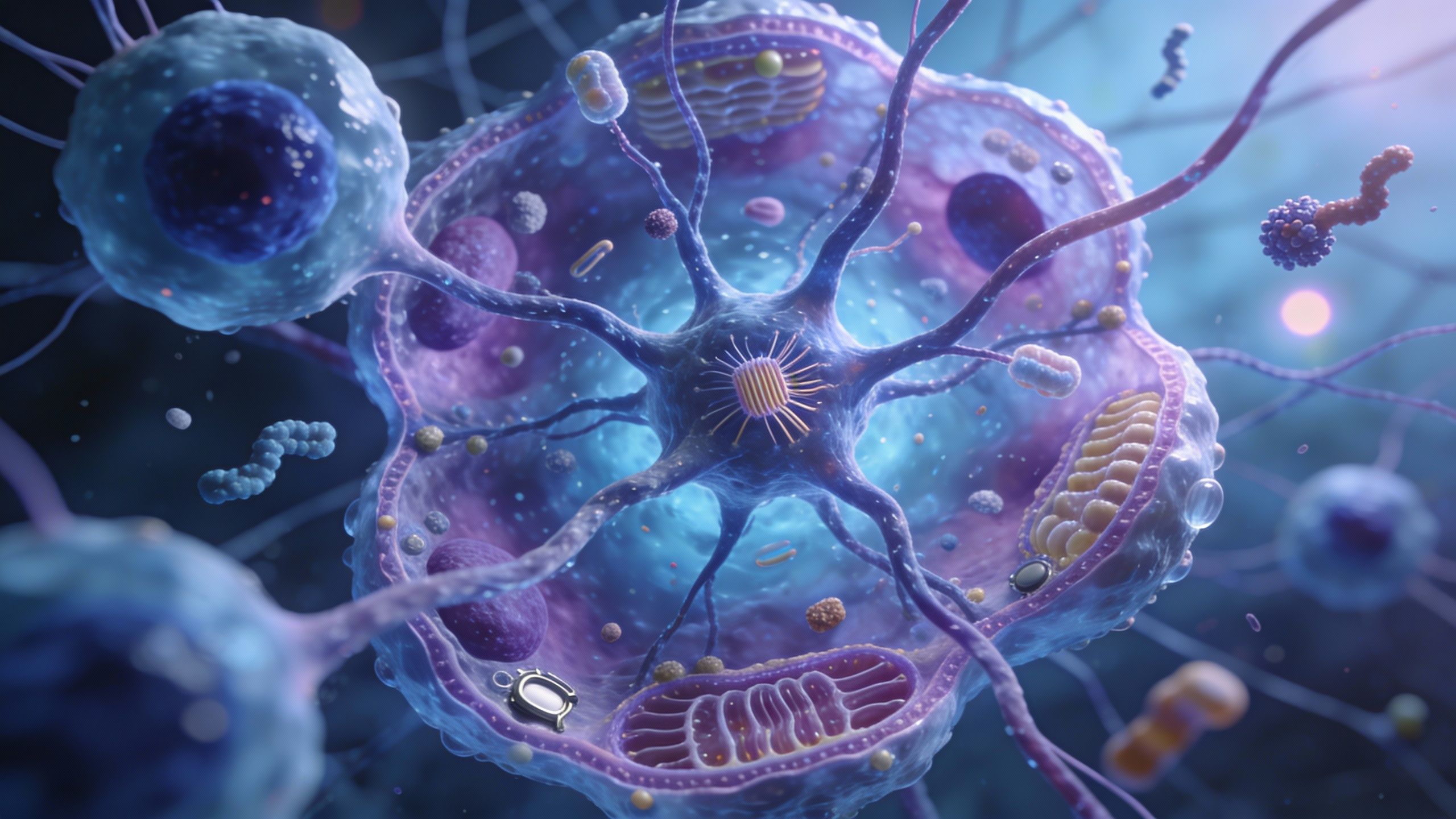
Il faut comprendre ce qu’il se passe là-dedans pour saisir le génie de leur approche. C’est un véritable cercle vicieux. Les cellules qui tapissent le kyste fabriquent des facteurs de croissance et les sécrètent directement dans le liquide du kyste. Ensuite ? Eh bien, ces facteurs reviennent se fixer sur ces mêmes cellules ou leurs voisines pour les stimuler encore et encore. Weimbs décrit cela comme un « schéma sans fin » où les cellules ne cessent de s’auto-activer. C’est un peu comme si elles se criaient des ordres mutuels de grandir sans jamais s’arrêter.
La prémisse des chercheurs était donc la suivante : si l’on parvient à bloquer soit le facteur de croissance, soit son récepteur, on devrait pouvoir stopper cette agitation permanente. C’est logique sur le papier, mais encore fallait-il trouver le bon outil pour entrer dans la place sans tout casser.
S’inspirer de nos propres larmes

C’est ici qu’entre en scène un nouvel acteur : l’immunoglobuline A dimérique, ou dIgA. C’est un anticorps monoclonal un peu spécial capable de traverser les membranes épithéliales. La nature fait bien les choses, car notre corps libère naturellement ce dIgA dans le mucus, la salive et même les larmes pour nous défendre contre les pathogènes. Une idée brillante, je trouve. Déjà en 2015, Weimbs et son équipe avaient suggéré que le dIgA pourrait se lier à certains récepteurs et se faufiler jusqu’aux kystes rénaux.
L’étude actuelle, qui poursuit ces travaux, montre qu’il est possible de cibler un coupable majeur de cette croissance anarchique : le récepteur cMET (transition mésenchymateuse-épithéliale). En gros, ils ont détourné un mécanisme naturel de défense pour l’utiliser comme un cheval de Troie thérapeutique.
Bricolage génétique et résultats prometteurs

Concrètement, comment ont-ils fait ? Les chercheurs ont joué aux ingénieurs en modifiant la séquence ADN de l’anticorps IgG classique pour lui donner une « colonne vertébrale différente », le transformant ainsi en anticorps dIgA. Après avoir vérifié que cette protéine redessinée reconnaissait bien sa cible, ils l’ont testée sur des souris. Et devinez quoi ? L’anticorps a réussi à atteindre les kystes et, surtout, à y rester.
La question suivante était évidemment : est-ce que ça marche ? « La question suivante était : pourrait-il réellement bloquer ce récepteur de facteur de croissance particulier ? », se demandait Weimbs. Les résultats sont là : une baisse de l’activité du cMET et, plus impressionnant encore, un déclenchement spectaculaire de l’apoptose — c’est-à-dire la mort cellulaire — uniquement dans les cellules kystiques. Le tissu rénal sain, lui, n’a pas bougé d’un cil. Aucun effet secondaire nocif n’a été observé, ce qui est plutôt rassurant.
L’avenir et les artisans de cette découverte

Bon, ne nous emballons pas trop vite non plus, c’est encore du stade préclinique. Weimbs précise qu’il faudra du temps avant qu’une telle thérapie n’arrive chez l’homme. Il y a des douzaines de facteurs de croissance actifs dans ces fluides, donc l’idée serait de comparer le blocage de plusieurs d’entre eux, voire de combiner différents anticorps. « Ce serait la prochaine étape », dit-il. L’équipe cherche d’ailleurs des collaborateurs et des installations pour pousser ces recherches plus loin.
Il faut rendre hommage à ceux qui ont bossé dur sur ce projet publié le 5 septembre 2025 (DOI : 10.1016/j.xcrm.2025.102335). Outre Thomas Weimbs, il y a l’auteure principale Margaret F. Schimmel, ainsi que Bryan C. Bourgeois, Alison K. Spindt, Sage A. Patel, Tiffany Chin, Gavin E. Cornick et Yuqi Liu (ou peut-être Lu, les sources varient parfois) de l’UCSB. Sans oublier le soutien financier vital des Instituts nationaux de la santé, du ministère de la Défense, de la Fondation Amy P. Goldman et du Lillian Goldman Charitable Trust. Bravo à eux.
Ce contenu a été créé avec l’aide de l’IA.