Mesurer l’extension quantique d’une molécule unique confinée dans une nanogoutte
Auteur: Mathieu Gagnon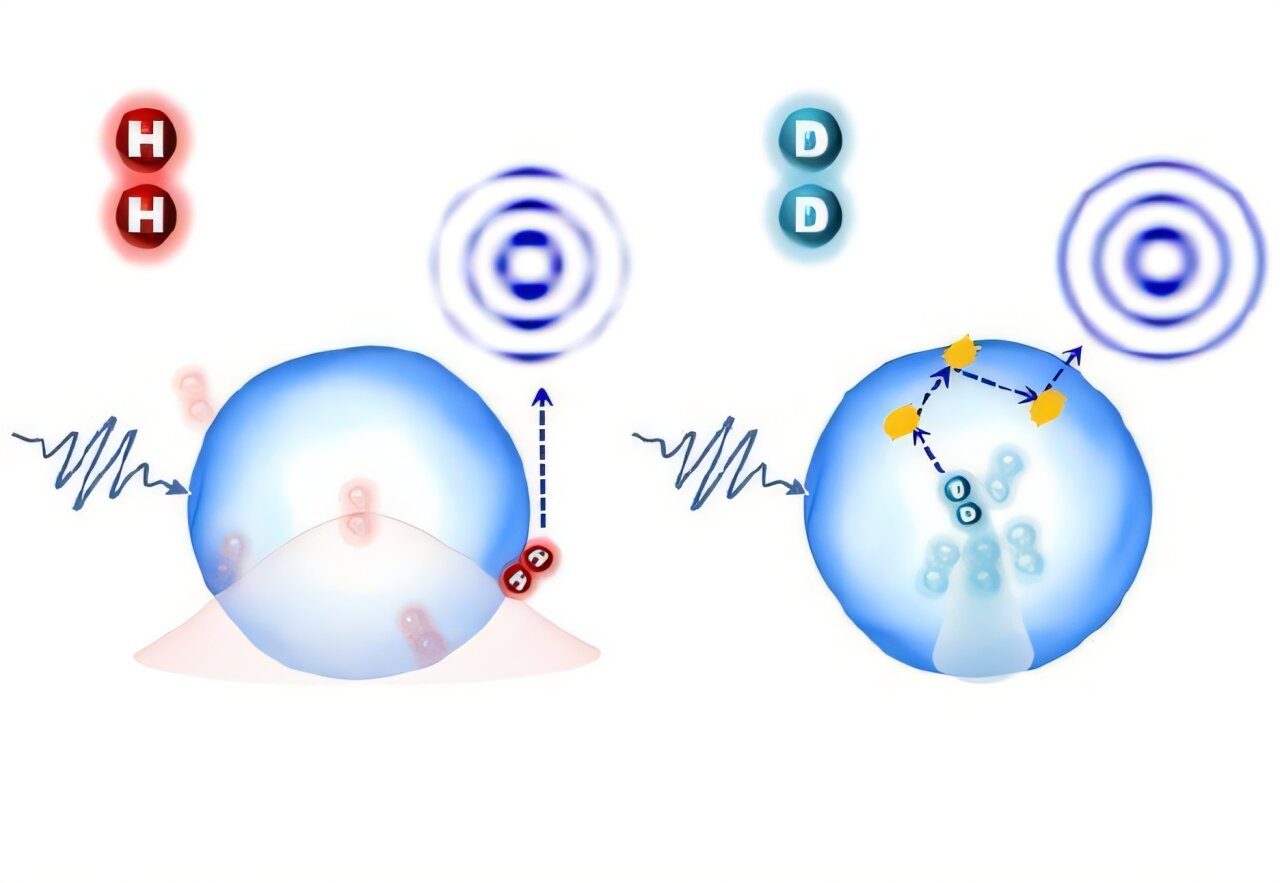
Chasser le fantôme dans la machine

C’est l’un des grands paradoxes de la physique : on ne peut pas mesurer directement la fonction d’onde d’un système quantique. Pourtant, c’est elle qui définit tout. En gros, son carré (un nombre complexe) nous donne la densité de probabilité, c’est-à-dire les chances de trouver une particule à un endroit précis. Mais pour la voir ? Impossible. Du moins, c’était le cas jusqu’à ce qu’une équipe de scientifiques chinois décide de piéger une molécule solitaire dans une prison glacée.
Leur étude, publiée récemment dans les prestigieuses Physical Review Letters, change la donne. Pour comprendre l’exploit, il faut remonter un peu le temps. En 1926, Erwin Schrödinger publie sa célèbre équation. Sur le moment, la signification de la fonction d’onde qu’elle permet de calculer reste floue. C’est Max Born, plus tard la même année, qui propose la clé de l’énigme : le carré de cette fonction représente la probabilité de présence physique. Cela a permis de relier la théorie abstraite aux résultats expérimentaux réels.
Imaginez une particule libre, comme un électron chez vous. En théorie, sa fonction d’onde s’étend à l’infini. Il existe une chance infime, mais non nulle, qu’il soit actuellement dans la galaxie d’Andromède. Bon, concrètement, cette probabilité est si faible qu’elle est insignifiante. Mais si on confine cette particule ? C’est le fameux problème de la « particule dans une boîte ». Les murs de la boîte forcent la probabilité à devenir nulle à l’extérieur, créant des niveaux d’énergie quantifiés à l’intérieur.
Un laboratoire plus froid que l’espace

C’est exactement ce principe que l’équipe de Ye et ses collègues a appliqué, mais avec une finesse incroyable. Ils ont piégé une molécule d’hydrogène (H2) ou de deutérium (D2) à l’intérieur d’une nanogouttelette d’hélium. Contrairement à une boîte théorique aux murs infinis, l’hélium exerce une force de résistance finie. Résultat ? La mécanique quantique implique non seulement des niveaux d’énergie précis, mais aussi des « fuites » de la fonction d’onde et un effet tunnel près des bords de la goutte. En clair, l’objet traverse le mur même sans avoir l’énergie suffisante pour le faire, un phénomène impossible dans notre monde classique.
Pour réussir cela, il a fallu refroidir l’ambiance. À température ambiante (300 Kelvin), la longueur d’onde de matière d’une molécule H2 est minuscule : 0,07 nanomètre. C’est trop petit pour être observé facilement. Mais en descendant à 0,37 Kelvin — bien en dessous de la température de transition superfluide de l’hélium fixée à 2,17 K — cette longueur d’onde s’étire jusqu’à 2,0 nanomètres. C’est énorme à cette échelle !
Les chercheurs ont généré un flux de gouttelettes d’hélium d’environ 4 nanomètres de diamètre (contenant environ 1 000 atomes d’hélium). Ils les ont fait passer dans une cellule contenant du gaz H2, D2 ou O2. Ensuite, ils ont tiré dessus avec un laser ultraviolet. Le but ? Éjecter un électron de la molécule piégée. En sortant, cet électron rebondit sur l’environnement d’hélium. En analysant la distribution de l’impulsion finale de cet électron sur un capteur, l’équipe a pu reconstituer ce qui se passait à l’intérieur.
Quand la masse change tout

Les résultats visuels sont fascinants. Pour les molécules de deutérium (D2), les images obtenues étaient floues. Pourquoi ? Parce que les électrons émis avaient subi de multiples collisions en traversant la gouttelette, signe qu’ils partaient de loin, profondément enfouis. À l’inverse, pour l’hydrogène (H2), les motifs étaient nets et clairs, indiquant une diffusion minimale. Cela signifie que la fonction d’onde de l’hydrogène est large, occupant presque tout le rayon de la gouttelette (environ 2 nm), tandis que celle du deutérium reste petite et recroquevillée au centre.
Mais pourquoi une telle différence ? C’est une question de poids. Le deutérium est un isotope de l’hydrogène : il possède un neutron en plus de son proton, ce qui le rend plus lourd. L’hydrogène (H2), plus léger, possède une énergie vibrationnelle plus élevée. Sa fréquence de vibration est plus rapide et son état d’énergie le plus bas — ce qu’on appelle l’énergie du point zéro — est plus haut.
La théorie nous dit que cette énergie varie comme l’inverse de la racine carrée de la masse. Conséquence directe : le nuage de matière de la molécule légère (H2) est plus étalé, plus « délocalisé ». La molécule lourde (D2), elle, reste plus localisée. L’équipe a même testé avec de l’oxygène (O2), encore plus lourd, et son étendue spatiale était encore plus réduite. Ces observations confirment parfaitement les prédictions théoriques.
Vers une nouvelle ère nanoscopique

Alors, qu’est-ce qu’on fait de tout ça ? Ce n’est pas juste une victoire pour les manuels de physique. Comme l’écrivent les chercheurs, ces motifs distincts proviennent directement du comportement quantique des molécules et de leur degré de localisation ou de délocalisation. C’est une fenêtre ouverte sur l’intimité de la matière.
Cette capacité à comprendre et mesurer la délocalisation de molécules légères et froides dans des gouttelettes d’hélium est prometteuse. Elle pourrait accélérer les progrès en chimie quantique et en physique de la matière condensée. On peut imaginer, à terme, la conception de nouveaux dispositifs à l’échelle nanométrique capables d’exploiter ces propriétés uniques. Nous ne sommes peut-être qu’au début de l’ingénierie quantique de demain.
Selon la source : phys.org
Créé par des humains, assisté par IA.









