Une loterie biologique qui n’en est peut-être pas une

Pourquoi certaines personnes traversent-elles la vie sans encombre alors que d’autres développent des maladies graves apparemment sans raison ? Ce que l’on a longtemps attribué au hasard médical ou à la simple malchance commence à révéler ses mécanismes profonds. Une récente étude d’envergure suggère que notre destin sanitaire face aux infections virales est, en partie, écrit dans nos gènes dès la naissance.
Les chercheurs se sont penchés sur la capacité de notre système immunitaire à contrôler les infections latentes. Contrairement aux virus qui attaquent et disparaissent, certains pathogènes s’installent durablement dans notre organisme. C’est ici que l’hérédité entre en jeu : des signaux inscrits dans notre ADN déterminent l’efficacité avec laquelle notre corps va contenir ces intrus sur le très long terme.
Le virus Epstein-Barr, omniprésent à l’échelle planétaire, est au cœur de cette découverte majeure. Si sa présence semblait jusqu’alors anodine pour la majorité des porteurs, on découvre aujourd’hui qu’il pourrait moduler durablement le risque de développer des pathologies lourdes. Tout dépendrait en réalité de la combinaison entre ce virus et notre patrimoine génétique personnel.
Un locataire silencieux présent chez 90 % de la population
Le virus Epstein-Barr n’est pas un inconnu pour la médecine, ni pour le grand public. Membre de la famille des herpès, il circule discrètement dans l’organisme de milliards d’êtres humains. On estime qu’il est présent chez plus de 90 % de la population mondiale. Pour la plupart d’entre nous, l’infection passe inaperçue ou se manifeste par une mononucléose infectieuse, avant que le virus ne se fasse oublier.
Cependant, ce calme n’est qu’apparent. Chez une minorité d’individus, le virus ne se contente pas de dormir : il persiste durablement dans les cellules, parfois à des niveaux anormalement élevés. Cette persistance virale a longtemps été considérée comme inoffensive par les médecins, faute de preuves contraires tangibles.
Pourtant, les scientifiques soupçonnaient déjà un lien entre ce virus et des troubles graves. Des associations avaient été observées avec certains cancers du système lymphatique ou des maladies auto-immunes comme le lupus et la sclérose en plaques. L’étude publiée récemment dans la revue Nature vient confirmer ces soupçons en changeant d’échelle : elle quantifie pour la première fois cette menace silencieuse chez des centaines de milliers de personnes en apparente bonne santé.
Une enquête génétique sur 750 000 profils

Pour comprendre pourquoi ce virus reste sage chez certains et devient dangereux chez d’autres, les auteurs de l’étude ont déployé une méthodologie inédite. Ils ne se sont pas contentés d’observer les symptômes, mais sont allés chercher la réponse à la source même de notre biologie. Ils ont utilisé les séquençages ADN issus de deux immenses bases de données : la UK Biobank au Royaume-Uni et le programme All of Us aux États-Unis.
L’approche est techniquement fascinante : les chercheurs ont extrait informatiquement les fragments spécifiques du virus Epstein-Barr présents dans le sang des participants. Au total, ce sont près de 750 000 génomes qui ont été passés au crible. L’objectif était de débusquer les traces virales persistantes invisibles par des examens classiques.
Cette analyse de masse a permis de diviser la population étudiée en groupes distincts. Elle offre une photographie précise de l’interaction entre le génome humain et le génome viral, permettant enfin de dépasser les simples hypothèses pour établir des statistiques robustes sur la présence active ou latente du virus.
Quand le système immunitaire manque sa cible
Les résultats de cette investigation sont édifiants. Environ 10 % des individus analysés portaient une charge virale mesurable, signe d’une infection active ou d’une latence anormalement élevée. Ce sous-groupe se distingue nettement des 90 % d’adultes qui sont simplement séropositifs sans charge virale détectable. La différence entre ces deux groupes ? Elle réside dans leur profil génétique.
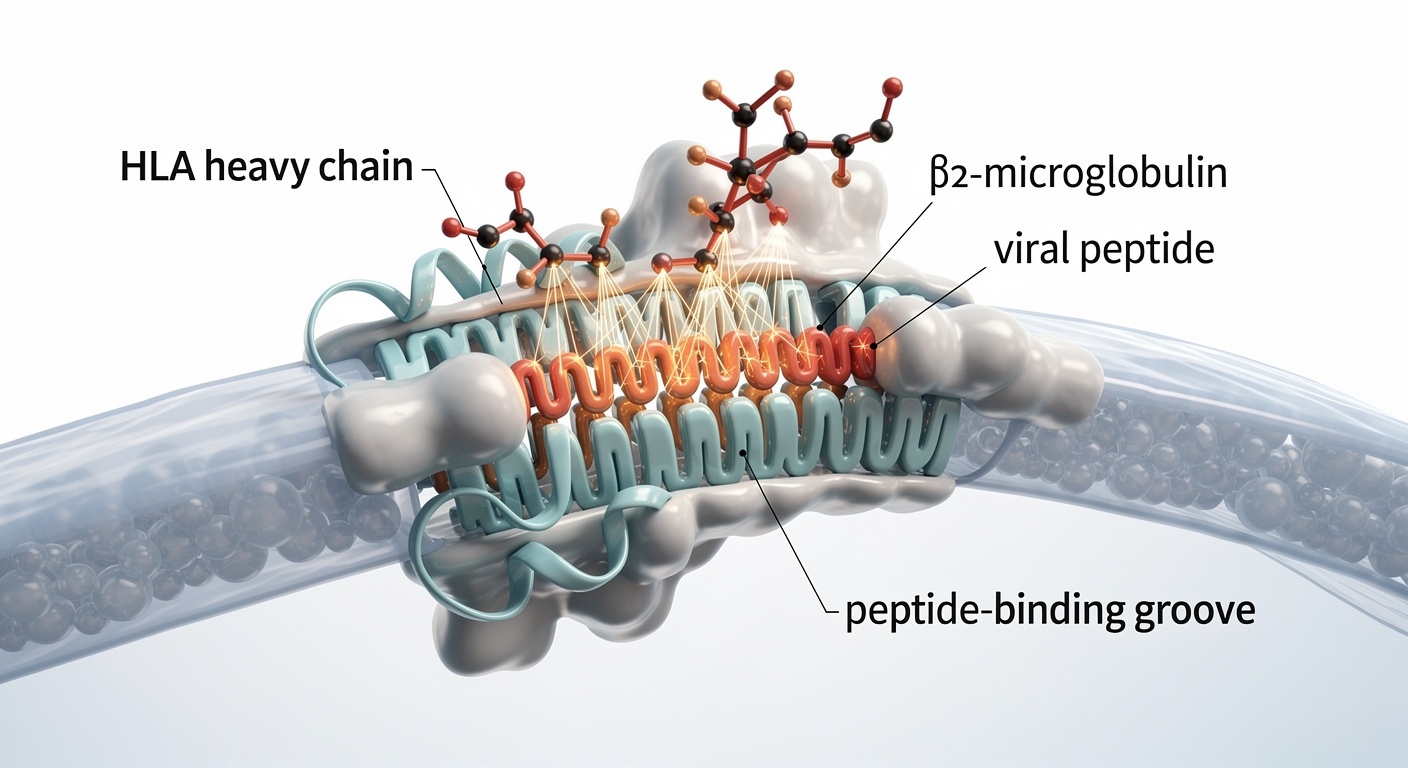
Les scientifiques ont réussi à identifier 22 régions spécifiques du génome humain (des loci) associées à cette présence accrue d’ADN viral. La majorité de ces variations se situent dans des zones régissant l’immunité, et plus précisément au niveau du complexe majeur d’histocompatibilité (HLA). Ce système est connu pour son rôle de sentinelle : c’est lui qui présente les antigènes aux cellules de défense pour déclencher la riposte.
L’utilisation de l’algorithme de prédiction NetMHC a permis d’aller plus loin dans la compréhension du mécanisme. Il apparaît que les individus dont les gènes HLA présentent moins efficacement les peptides du virus sont exactement ceux qui affichent les taux les plus élevés d’ADN viral dans le sang. En d’autres termes, certaines variantes génétiques empêchent le corps de « voir » correctement l’ennemi pour l’éliminer.
Un virus qui révèle nos faiblesses cachées
Les implications de cette cartographie génétique dépassent largement la simple virologie. L’étude établit des corrélations solides entre une charge virale persistante et une multitude de pathologies. Au-delà des lymphomes et des troubles auto-immuns, les chercheurs ont trouvé des liens avec certaines maladies cardiaques, rénales, et même des épisodes dépressifs. Au total, des correspondances significatives ont été relevées avec plus de 270 diagnostics médicaux.
Les chercheurs proposent désormais un nouveau modèle de compréhension : la capacité à contenir le virus après l’infection initiale dépend de mécanismes hérités de nos parents. Ces mécanismes influencent notre trajectoire de santé sur le long terme. Le virus Epstein-Barr agirait ainsi comme un révélateur, voire un amplificateur silencieux, des vulnérabilités génétiques propres à chaque individu.
Ce travail, relayé notamment par LiveScience, marque un tournant dans l’analyse du virome humain. Il suggère que d’autres virus endémiques pourraient avoir un impact similaire une fois la phase aiguë passée. Cette découverte pourrait redéfinir la médecine préventive en permettant de cibler spécifiquement les patients porteurs de ce risque génétique jusqu’alors invisible.
Selon la source : science-et-vie.com
Créé par des humains, assisté par IA.