Ces « filets » oubliés qui font perdre la mémoire sociale aux malades d’alzheimer
Auteur: Adam David
C’est l’une des étapes les plus déchirantes de la maladie d’Alzheimer : le moment où un patient ne reconnaît plus les visages de ses enfants ou de son conjoint. Cette perte de la mémoire sociale, si dévastatrice pour l’entourage, pourrait enfin avoir une explication mécanique claire, ouvrant la voie à des traitements ciblés.
Selon une étude récente, la cause résiderait dans l’altération des « filets protecteurs » entourant nos neurones, appelés réseaux périneuronaux. Ce phénomène, indépendant de l’accumulation des fameuses plaques amyloïdes, perturbe la communication essentielle au stockage des souvenirs affectifs. Cette découverte, si elle se confirmait chez l’humain, offre une lueur d’espoir pour restaurer ces liens vitaux.
L’ampleur d'une épidémie silencieuse

La maladie d’Alzheimer demeure la forme de démence la plus répandue, touchant actuellement près de 55 millions de personnes dans le monde. Avec le vieillissement global de la population, les projections sont alarmantes : on anticipe une augmentation d’environ 35 % du nombre de cas dans les années à venir. C’est un enjeu de santé publique majeur qui pèse sur toutes les sociétés.
Si les premiers symptômes peuvent paraître anodins — une légère perte de concentration, des mots qui manquent à l’appel —, l’évolution de la maladie est souvent inexorable. Elle mène progressivement à des déficits cognitifs majeurs, l’empêchant finalement d’effectuer les tâches les plus élémentaires de la vie quotidienne, comme s’habiller ou s’alimenter sans assistance.
La tragédie de la mémoire sociale

Mais au-delà des fonctions motrices, c’est bien la perte de la mémoire sociale qui est perçue comme la plus grande tragédie par les familles. Ce déclin commence par l’oubli d’un nom, puis l’incapacité à mettre un visage sur une relation passée. Aux stades avancés, le patient est non seulement incapable de reconnaître ses proches, mais il perd également la faculté d’interpréter les signaux sociaux les plus subtils.
Ce processus mène inévitablement vers un isolement profond et douloureux, pour le patient comme pour ceux qui l’entourent et qui se sentent oubliés. C’est face à ce symptôme dévastateur que les chercheurs de l’Université de Virginie ont concentré leurs efforts.
Une théorie remise en question
Pendant longtemps, l’explication dominante de la maladie a reposé sur la théorie dite de la « cascade amyloïde ». Il était admis que l’accumulation de plaques protéiques amyloïdes et des enchevêtrements de protéine tau entraînait la destruction progressive des neurones et des synapses. C’était la voie pathologique principale que la recherche s’efforçait de contrecarrer.
Or, force est de constater que cette hypothèse maîtresse montre ses limites. Les thérapies développées spécifiquement pour éliminer ces protéines toxiques n’ont eu qu’une efficacité très limitée. C’est pourquoi la communauté scientifique explore d’autres pistes prometteuses, allant du dysfonctionnement mitochondrial aux problèmes de microbiote intestinal, cherchant une cause plus fondamentale à l’étiologie complexe de la maladie.
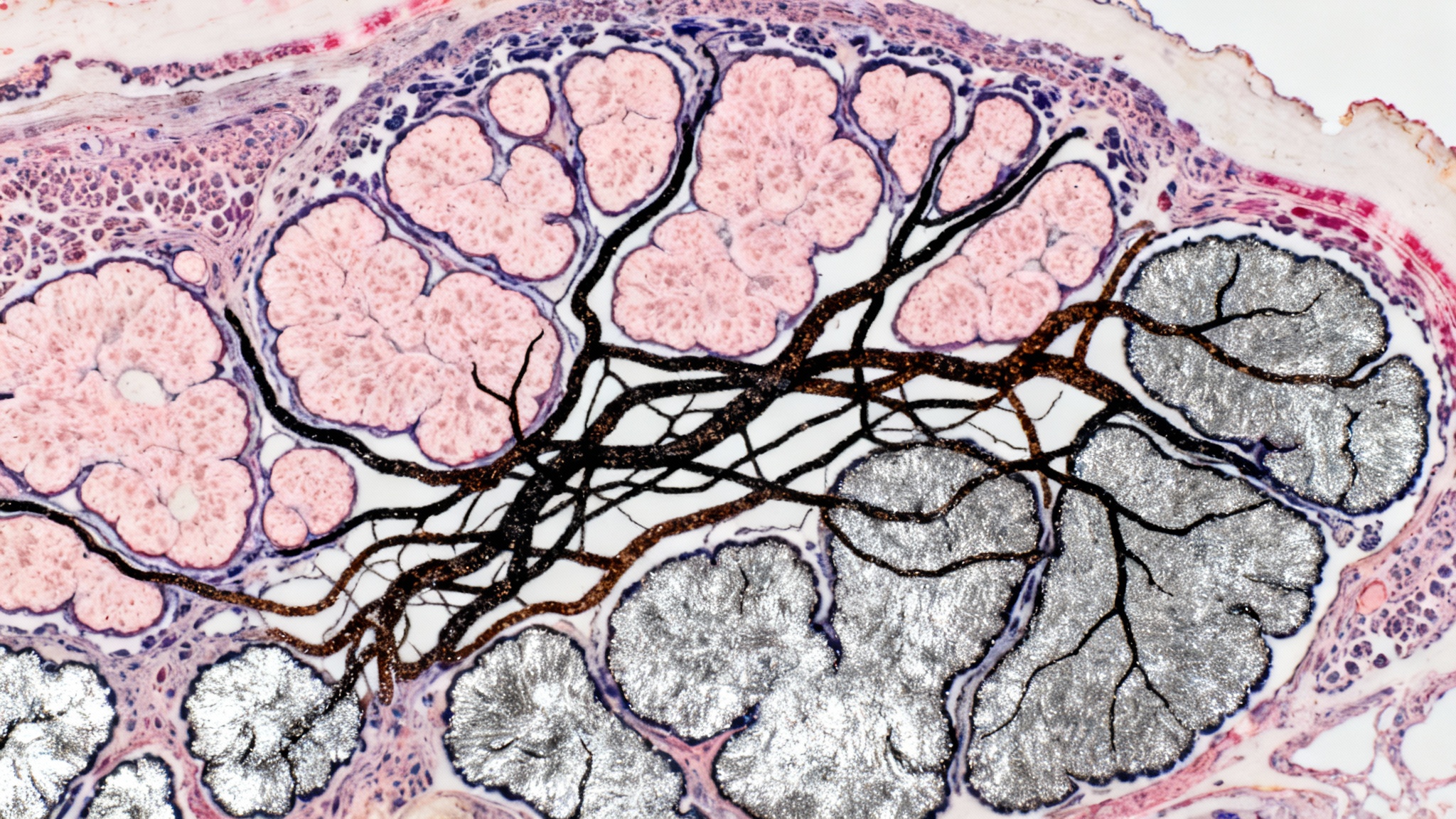
Le filet de sécurité des neurones
L’équipe de l’Université de Virginie propose donc une nouvelle voie pathologique, impliquant une altération structurelle précise : les réseaux périneuronaux (PNNs). Ces PNNs sont des composantes de la matrice extracellulaire cérébrale. On peut les imaginer comme de fines enveloppes, semblables à des mailles délicates, qui entourent et soutiennent physiquement les neurones.
Leur rôle est crucial pour la fonction synaptique ; ils stabilisent les connexions et garantissent une communication optimale, notamment dans des régions clés pour la cognition et la mémoire comme l’hippocampe. Des études antérieures avaient déjà noté que ces structures se dégradaient dans le cerveau des patients, mais sans établir formellement le lien de causalité avec la perte de mémoire sociale.
Une cible spécifique testée sur la souris

Les chercheurs, dont les travaux ont été publiés dans la revue Alzheimer’s & Dementia, ont formulé l’hypothèse selon laquelle le dysfonctionnement de ces PNNs serait un mécanisme déterminant dans la perte des souvenirs sociaux. Pour tester cette idée, ils ont utilisé des modèles murins dont les PNNs avaient été spécifiquement endommagés.
Les résultats ont été édifiants : ces souris présentaient des difficultés marquées à se souvenir d’autres congénères. Cependant, fait révélateur, elles conservaient leur capacité à mémoriser des objets dans leur environnement. Cette spécificité, qui reflète celle observée chez l’humain, suggère fortement que les altérations des PNNs pourraient être directement responsables du processus qui fait oublier à un patient ses proches.
Vers une nouvelle approche thérapeutique
L’aspect le plus prometteur de cette étude réside dans l’exploration d’une solution. En utilisant des inhibiteurs de MMP – une catégorie de médicaments déjà étudiée pour d’autres pathologies comme l’arthrite –, l’équipe a réussi à freiner la dégradation des PNNs chez les rongeurs, préservant ainsi leur mémoire sociale. Ce processus s’est d’ailleurs déroulé sans aucune dépendance à la pathologie amyloïde, renforçant l’idée que la cascade amyloïde n’est peut-être pas la cause principale de la maladie.
« Nos recherches nous permettront de nous rapprocher d’une nouvelle approche thérapeutique, voire préventive, contre la maladie d’Alzheimer, une approche dont nous avons cruellement besoin aujourd’hui », a déclaré Lata Chaunsali, auteur principal de l’étude. Bien que ces résultats ouvrent une porte immense, les chercheurs insistent sur le fait que de nombreux travaux restent nécessaires avant d’envisager l’application de ce traitement chez l’humain.
Selon la source : trustmyscience.com