Une découverte qui change la donne à l’Université de Californie

C’est une de ces découvertes qui nous force à revoir ce que l’on pensait savoir sur la fragilité de notre corps. Vous savez, on a tendance à blâmer notre alimentation ou le stress quand le ventre va mal, mais parfois, la réponse est écrite bien plus profondément, dans notre code génétique. Récemment, des chercheurs de l’Université de Californie à Riverside ont mis le doigt sur quelque chose de fascinant. Ils ont publié non pas une, mais deux études majeures qui, je pense, vont faire du bruit.
Le coupable ? Un gène nommé PTPN2. C’est un peu technique, je vous l’accorde, mais imaginez-le comme un gardien de sécurité. Ces travaux, dirigés par le professeur de sciences biomédicales Declan McCole de l’École de médecine, nous révèlent que lorsque ce gardien – le gène PTPN2 – ne fait pas correctement son travail, notre intestin se retrouve, pour ainsi dire, avec la porte grande ouverte aux infections et à l’inflammation.
Ces recherches mettent en lumière un lien direct entre ce dysfonctionnement génétique et les maladies inflammatoires de l’intestin (MII). C’est un pas de géant pour comprendre pourquoi certaines personnes semblent souffrir de ces maux de manière chronique, alors que d’autres, avec le même mode de vie, ne ressentent rien.
Quand le gardien baisse la garde : l’invasion bactérienne
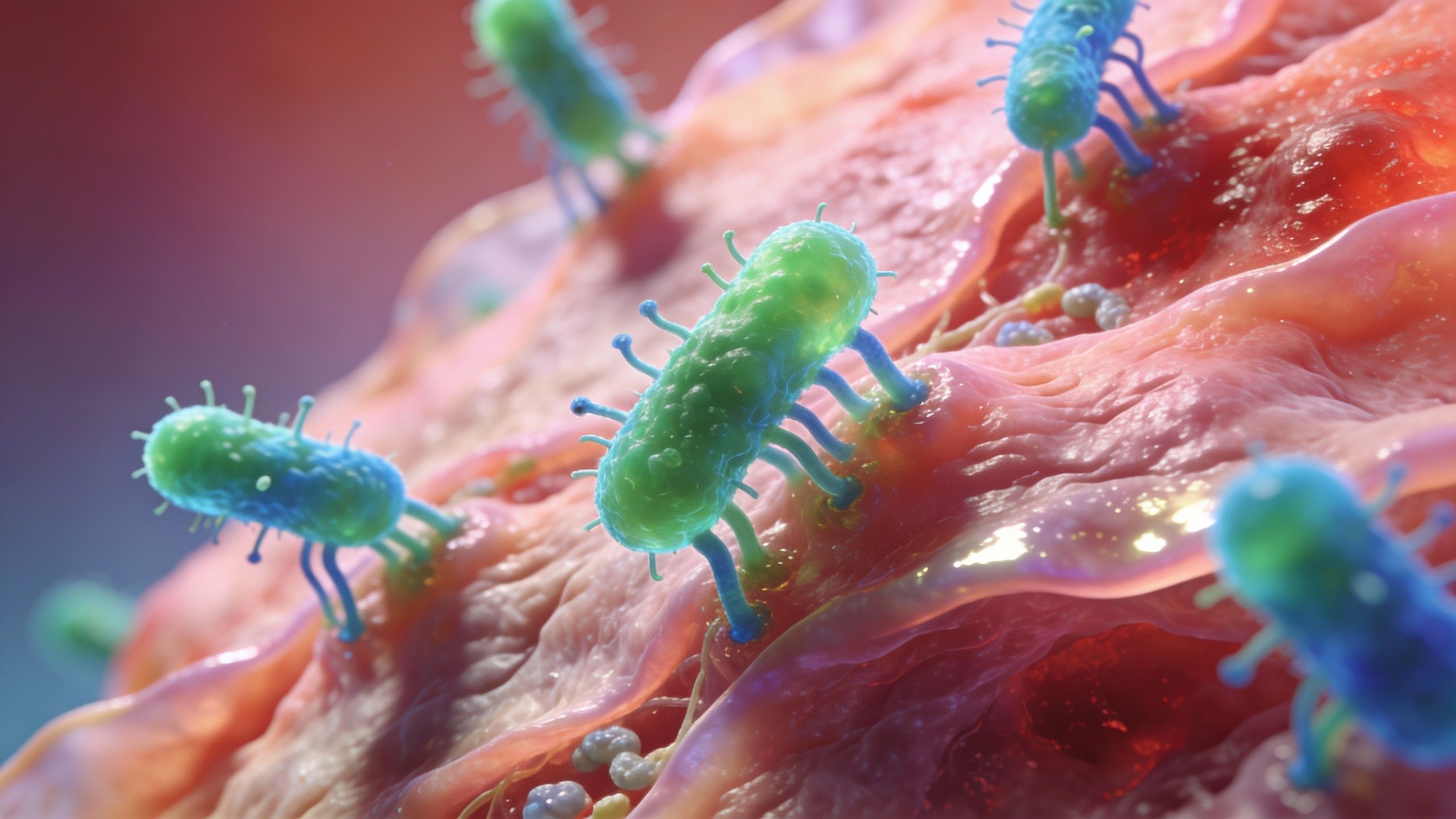
Alors, que se passe-t-il concrètement à l’intérieur ? Eh bien, il s’avère que les personnes souffrant de maladies inflammatoires de l’intestin présentent souvent des niveaux élevés d’un type de bactérie particulièrement agressif. On l’appelle AIEC, ce qui est une façon plus courte de désigner une forme nocive de la bactérie E. coli. Ce n’est pas la bactérie inoffensive que nous avons tous ; celle-ci est une vraie brute. Elle s’accroche aux parois de l’intestin, envahit les cellules et saccage la barrière protectrice, ce qui aggrave terriblement l’inflammation.
Dans un corps qui fonctionne « normalement », le gène PTPN2 est là pour maintenir l’ordre. Il contrôle l’inflammation et s’assure que le microbiome intestinal reste équilibré. Mais voilà le hic : certaines personnes portent une version défectueuse de ce gène. C’est un peu comme avoir un système d’alarme dont les piles sont à plat. Cette version fautive réduit l’activité de PTPN2, et soudain, l’équilibre est rompu. L’intestin devient alors beaucoup plus vulnérable aux microbes nocifs.
Le professeur McCole et son équipe ont constaté que cette perte de protection permet à des bactéries comme l’AIEC de se fixer, d’envahir la paroi intestinale et de se multiplier avec une facilité déconcertante. Comme l’explique McCole lui-même : « Nos résultats aident à expliquer pourquoi certaines personnes sont plus sujettes à une inflammation intestinale continue. » C’est une explication qui manquait cruellement à de nombreux patients jusqu’à présent.
Les mécanismes dévoilés et l’espoir d’un traitement

C’est là que les choses deviennent vraiment intéressantes – et un peu plus complexes, accrochez-vous. Dans leur premier article, intitulé de manière assez barbare « The PTPN2 rs1893217 IBD risk allele increases susceptibility to AIEC invasion by a JAK-STAT-CEACAM6 axis », les chercheurs ont fait quelque chose d’ingénieux. Ils ont examiné des tissus intestinaux de patients porteurs de ce gène défectueux, ainsi que des cellules cultivées en laboratoire et modifiées génétiquement pour reproduire ce défaut. Le verdict ? Quand PTPN2 est hors service, les cellules intestinales fabriquent davantage de « sites d’amarrage » à leur surface.
Imaginez des places de parking réservées spécifiquement pour les mauvaises bactéries ; c’est exactement ce qui se passe, permettant à l’AIEC d’entrer bien trop facilement. Mais il y a une lueur d’espoir. McCole précise : « Nous avons également constaté que le traitement avec un médicament déjà utilisé pour traiter les MII, appelé inhibiteur de JAK, pouvait partiellement réduire ce problème. » En gros, ce médicament limite la capacité des bactéries à envahir les cellules. C’est une piste thérapeutique majeure pour ceux qui sont génétiquement prédisposés.
La seconde étude, titrée « Intestinal epithelial PTPN2 limits pathobiont colonization by immune-directed antimicrobial responses », nous apprend que le rôle de PTPN2 ne s’arrête pas là. Ce gène aide aussi les cellules de la paroi intestinale à produire des substances naturelles qui tuent les bactéries – une sorte d’antibiotique interne, si vous voulez. McCole ajoute que cette protection fonctionne contre les bactéries normales mais aussi contre les nuisibles comme l’AIEC. « Lorsque PTPN2 fonctionne correctement, il aide à empêcher les mauvaises bactéries de pénétrer dans les cellules intestinales et de déclencher une inflammation », dit-il. C’est un système de défense à double tranchant qui, lorsqu’il échoue, laisse le champ libre à la maladie.
Vers une médecine plus personnalisée

Tout cela nous amène à une conclusion plutôt optimiste, malgré la complexité du problème. Ces deux articles, qui paraîtront officiellement dans le numéro de décembre 2025 de Gut Microbes (une revue de référence sur les interactions hôte-microbe, soit dit en passant), ne sont pas juste de la théorie. Ils ouvrent la porte à des stratégies concrètes.
Le professeur McCole souligne que ces recherches pointent vers des stratégies de traitement potentielles qui pourraient restaurer les défenses intestinales. L’idée serait de limiter spécifiquement les bactéries nocives chez les patients génétiquement à risque. On s’éloigne des traitements génériques pour aller vers quelque chose de beaucoup plus ciblé. C’est peut-être, finalement, le début d’une ère où l’on ne se contente plus de traiter les symptômes, mais où l’on répare les failles de notre propre armure génétique.
Selon la source : medicalxpress.com
Créé par des humains, assisté par IA.