Où vont vraiment nos médicaments ? Une découverte fascinante révèle des trajets inattendus dans le corps
Auteur: Mathieu Gagnon
Quand la science éclaire enfin l’invisible

Vous est-il déjà arrivé de vous demander, en avalant un comprimé le matin, où il allait exactement atterrir ? C’est une question qui paraît simple, mais la réponse est vertigineuse. Jusqu’à présent, c’était un peu comme jeter une bouteille à la mer en espérant qu’elle arrive à bon port. Eh bien, figurez-vous que des scientifiques viennent de lever le voile sur ce mystère. Ils peuvent désormais voir précisément à quelles cellules les médicaments se lient à travers tout le corps, révélant des cibles cachées qui pourraient bien expliquer pourquoi certains effets secondaires surviennent avant même que le traitement n’atteigne le patient.
C’est une avancée majeure, vraiment. En utilisant cette approche sur des souris, des chercheurs ont tracé le parcours de deux médicaments anticancéreux à travers les organes et les tissus, exposant des schémas de liaison que les tests standards ratent complètement. C’est fou quand on y pense, non ? Une liaison inattendue peut provoquer des dégâts lorsqu’une molécule s’accroche à la mauvaise protéine dans des tissus sains.
Tout ce travail a été dirigé par le Professeur Li Ye du Scripps Research. Son laboratoire traque ce qu’on appelle les médicaments covalents — ceux qui se lient de façon permanente aux protéines — pour tenter de comprendre pourquoi un traitement aide certaines cellules tout en en détruisant d’autres. Le problème avec la pharmacocinétique standard (la façon dont on mesure le mouvement des médicaments), c’est qu’elle nous donne souvent des moyennes par organe. C’est un peu comme si on vous donnait la température moyenne d’une maison sans vous dire que la cuisine est en feu. Ces moyennes cachent des cibles cellulaires rares. Souvent, les chercheurs broient les tissus pour des tests chimiques ou utilisent des scans à basse résolution qui floutent les signaux sur des milliers de cellules. Et ce flou… eh bien, il peut masquer un médicament qui se fixe dans le muscle cardiaque ou les vaisseaux sanguins, là où même un petit nombre de cellules touchées peut avoir de graves conséquences.
De la surface aux profondeurs : le défi technique du cuivre

Pour mieux cartographier tout ça, l’équipe de Ye avait déjà introduit en 2022 une méthode appelée CATCH. C’était un bon début, mais honnêtement, ça avait ses limites. Cette première approche mettait surtout en évidence la liaison des médicaments sur la surface des organes. Comme ça se faisait sur des coupes de tissus très fines, les marqueurs fluorescents avaient un mal fou à atteindre les régions profondes du cerveau ou du cœur. C’est là qu’ils ont innové avec leur nouvelle méthode, baptisée vCATCH. Elle s’appuie sur la précédente mais améliore l’accès chimique pour que le signal apparaisse aussi bien dans les couches externes que dans les cellules profondes.
Le principe est ingénieux. Les chercheurs modifient un médicament covalent avec une minuscule poignée chimique — un petit ajout pour un étiquetage ultérieur — avant de l’administrer aux animaux. Une fois que le médicament s’attache à sa cible, l’animal est échantillonné et cette poignée chimique est reliée à un colorant fluorescent. Comme le colorant est ajouté après le dosage, le médicament se comporte tout à fait normalement, mais ses sites de liaison finaux deviennent visibles. Tout repose sur la « click chemistry » (chimie click), une réaction qui joint deux molécules rapidement et proprement, en utilisant du cuivre comme assistant. Le professeur Ye explique d’ailleurs que cette chimie est « intrinsèquement hautement spécifique et efficace ». Ce n’est pas pour rien que le comité du prix Nobel a reconnu la chimie click comme une avancée majeure en 2022.
Mais attendez, il y a eu un hic. Un problème de cuivre assez tenace dans les tissus a dû être résolu avant que l’équipe ne puisse perfectionner la méthode vCATCH. Les protéines à l’intérieur des organes ont la fâcheuse tendance à accaparer les ions de cuivre, donc moins de cuivre atteint les cellules profondes où le marquage doit se faire. Sans assez de cuivre, le marquage fluorescent cale à la surface, laissant le centre sombre et la carte incomplète. Pour contourner ça, les chercheurs ont dû pré-tremper les organes avec du cuivre supplémentaire, puis lancer jusqu’à huit cycles de réaction pour pousser le marqueur plus profond. Le premier bain remplit les sites de liaison au cuivre communs, et les mélanges frais gardent du cuivre actif disponible pendant que le colorant s’attache. Grâce à une haute spécificité, ces bains répétés ne recouvrent pas les protéines non concernées, donc on peut se fier aux cellules marquées.
Et pour voir tout ça ? Il faut rendre les organes transparents. Oui, vous avez bien lu. Les tissus denses dispersent la lumière, donc les chercheurs utilisent le « tissue clearing » — l’élimination des graisses pour que les organes deviennent transparents — avant l’imagerie du corps entier. Les échantillons sont stabilisés avec un gel et scannés par un microscope qui balaie une fine feuille de lumière. Cela permet de voir les marqueurs fluorescents en 3D, plutôt que juste sur des tranches coupées.
Des téraoctets de données pour comprendre les effets secondaires
L’imagerie du corps entier, ça ne rigole pas. Cela peut générer plusieurs téraoctets de données par souris ! Autant dire qu’une révision manuelle est impossible pour n’importe quelle équipe humaine. C’est là que la technologie prend le relais : les ingénieurs ont construit un logiciel de vision par ordinateur pour détecter automatiquement les objets dans les images et signaler les cellules liées au médicament à travers les organes. Ces comptages cellulaires peuvent ensuite être alignés avec des cartes anatomiques pour révéler des schémas qui passeraient inaperçus autrement.
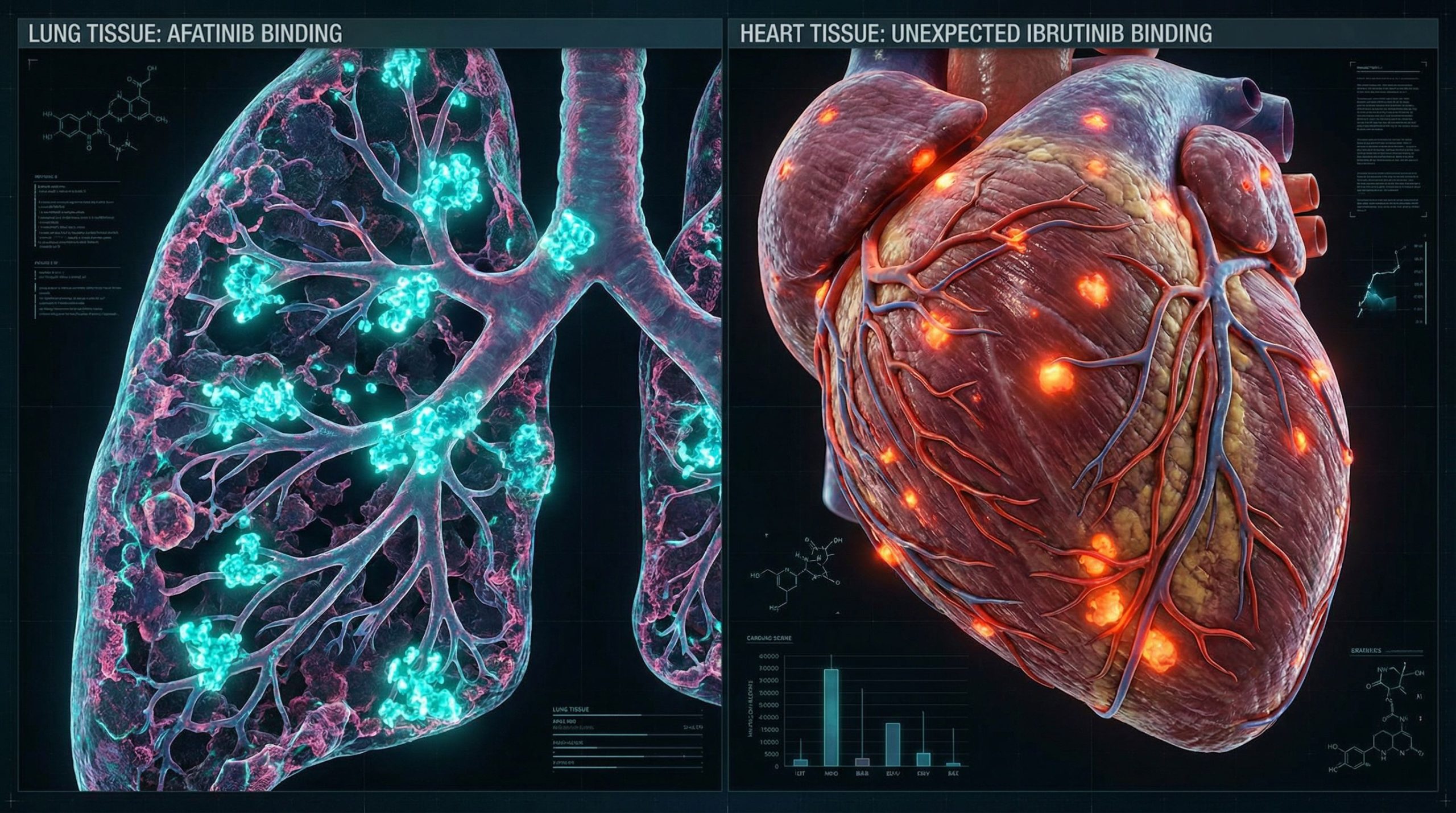
L’équipe a testé deux vrais médicaments anticancéreux pour voir ce que ça donnait. D’abord l’afatinib, vendu sous le nom de Gilotrif, pour le cancer du poumon non à petites cellules métastatique. Ensuite, l’ibrutinib, vendu comme Imbruvica, qui porte aux États-Unis des avertissements concernant des saignements et des problèmes de rythme cardiaque. Les deux forment des liaisons covalentes, ce qui les rend parfaits pour cette approche de marquage, mais leurs cartes de liaison… eh bien, elles diffèrent radicalement.
Dans les poumons, l’afatinib a illuminé de nombreux types de cellules, ce qui est logique pour une thérapie qui bloque un récepteur de signalisation de croissance. Les cartes montraient une liaison particulièrement forte à travers le tissu pulmonaire, ce qui aide à expliquer pourquoi le médicament peut atteindre des cellules tumorales dispersées. Ce schéma est crucial car il donne une base de référence pour juger quand d’autres médicaments se diffusent trop largement ou trop étroitement.
Par contre, pour l’ibrutinib, c’était une autre histoire. Le tissu cardiaque et les vaisseaux sanguins ont montré une liaison notable, un schéma qui n’était absolument pas attendu par rapport à sa cible principale contre le cancer. Le signal est apparu dans des cellules immunitaires à l’intérieur du foie et des parois des vaisseaux, suggérant que le médicament engage des protéines bien au-delà de son site prévu. En pointant ces cellules du doigt, on peut guider des tests de suivi pour connecter cette liaison aux effets secondaires, aux limites de dosage ou à des conceptions plus sûres.
Conclusion : Vers des traitements plus sûrs ?

Bien sûr, il faut rester prudent. L’interprétation d’une carte de liaison demande de la nuance, car certains signaux peuvent refléter des effets hors-cible, des actions du médicament sur des protéines involontaires. La méthode vCATCH étiquette des sondes de médicaments covalents, donc les scientifiques doivent confirmer que chaque sonde conserve le comportement du médicament parent. Mais les perspectives sont immenses.
Les chercheurs veulent maintenant tester des souris porteuses de tumeurs et des médicaments pour le cerveau, y compris des antidépresseurs et des antipsychotiques, pour voir quels types de cellules se lient. En reliant la liaison des médicaments à des cellules spécifiques, la méthode vCATCH peut transformer des effets secondaires vagues en une biologie testable chez les animaux. Même avec des sondes conçues soigneusement et des études de suivi, ces cartes du corps entier pourraient guider les chercheurs dans la sélection de candidats médicaments qui ciblent les bonnes cellules. Cette étude fascinante, qui pourrait bien changer la donne pour notre santé future, est publiée dans le journal Cell.
Ce contenu a été créé avec l’aide de l’IA.