Des os solides sans effort ? Une découverte cellulaire pourrait changer la donne pour les patients immobiles
Auteur: Mathieu Gagnon
Un interrupteur biologique caché au cœur de l’os
Comment le squelette parvient-il à rester robuste grâce à une simple marche ou une montée d’escaliers ? Cette question, centrale pour la compréhension de notre anatomie, trouve aujourd’hui un début de réponse moléculaire précise. Des chercheurs de la faculté de médecine de l’Université de Hong Kong (HKU) ont identifié un mécanisme sensoriel spécifique, niché au cœur de la moelle osseuse, capable de convertir le mouvement physique en croissance osseuse.
Le professeur Xu Aimin, endocrinologue à la faculté de médecine LKS de HKU, a dirigé ces recherches avec l’objectif de trouver des solutions pour les adultes fragiles. Son équipe a réussi à isoler un signal transmis par un type particulier de cellule souche. Cette découverte met en lumière un processus biologique fondamental qui restait jusqu’alors partiellement incompris.
Au centre de ce mécanisme se trouve Piezo1, une protéine sensible à la pression située sur les membranes cellulaires. Lorsque le corps est en mouvement, cette protéine s’ouvre sur les cellules souches de la moelle, permettant l’entrée de particules chargées. Ce flux guide littéralement le destin de la cellule, dictant sa transformation future et assurant le maintien de la densité osseuse.
La compétition cellulaire : entre fabrication d’os et stockage de graisse
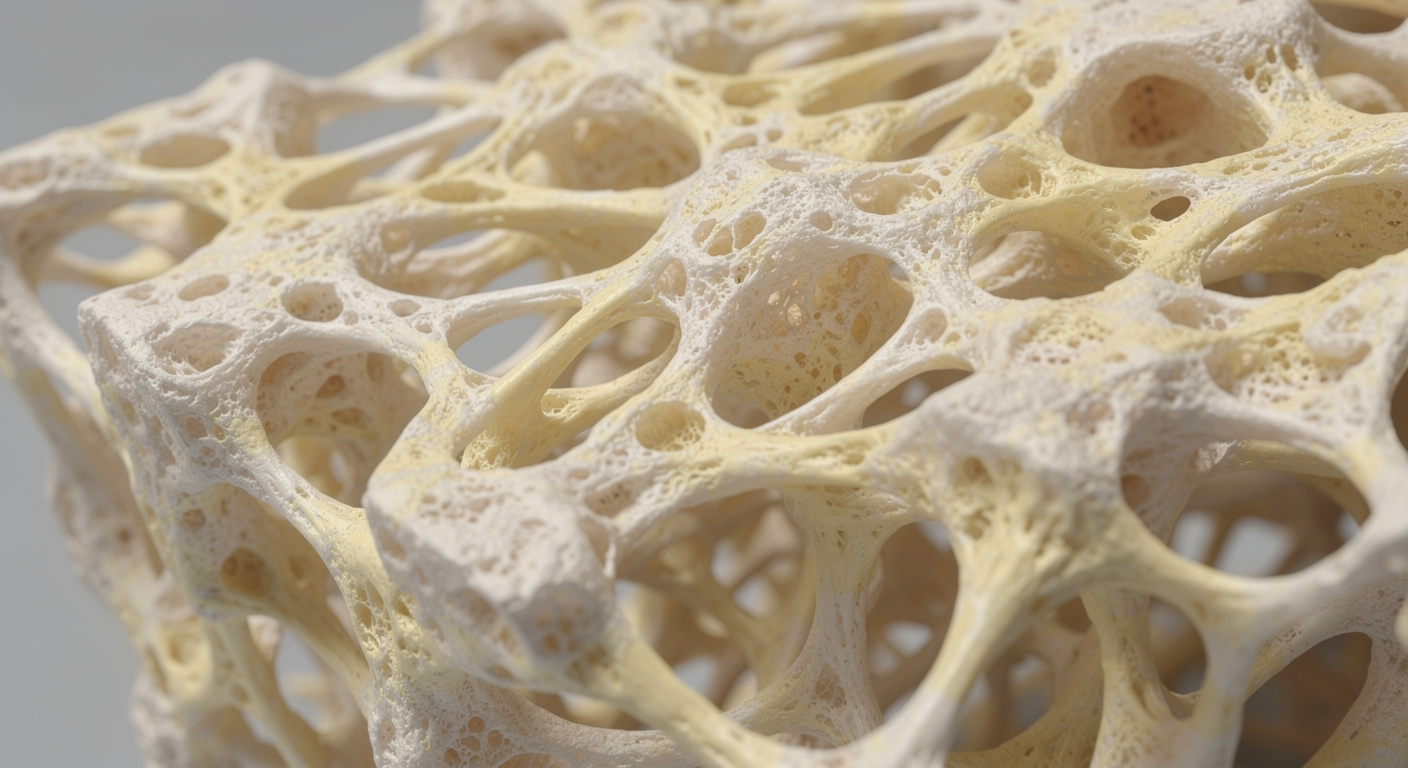
L’os est une structure vivante en perpétuel chantier, même chez les adultes dont la croissance est terminée depuis des décennies. Pour conserver leur solidité, les os doivent se reconstruire en permanence. Des cellules spécialisées, les ostéoblastes, déposent de nouveaux minéraux après chaque activité portant le poids du corps, tandis que d’autres cellules éliminent la matière ancienne. La solidité du squelette à long terme dépend de l’équilibre fragile entre ces deux tâches.
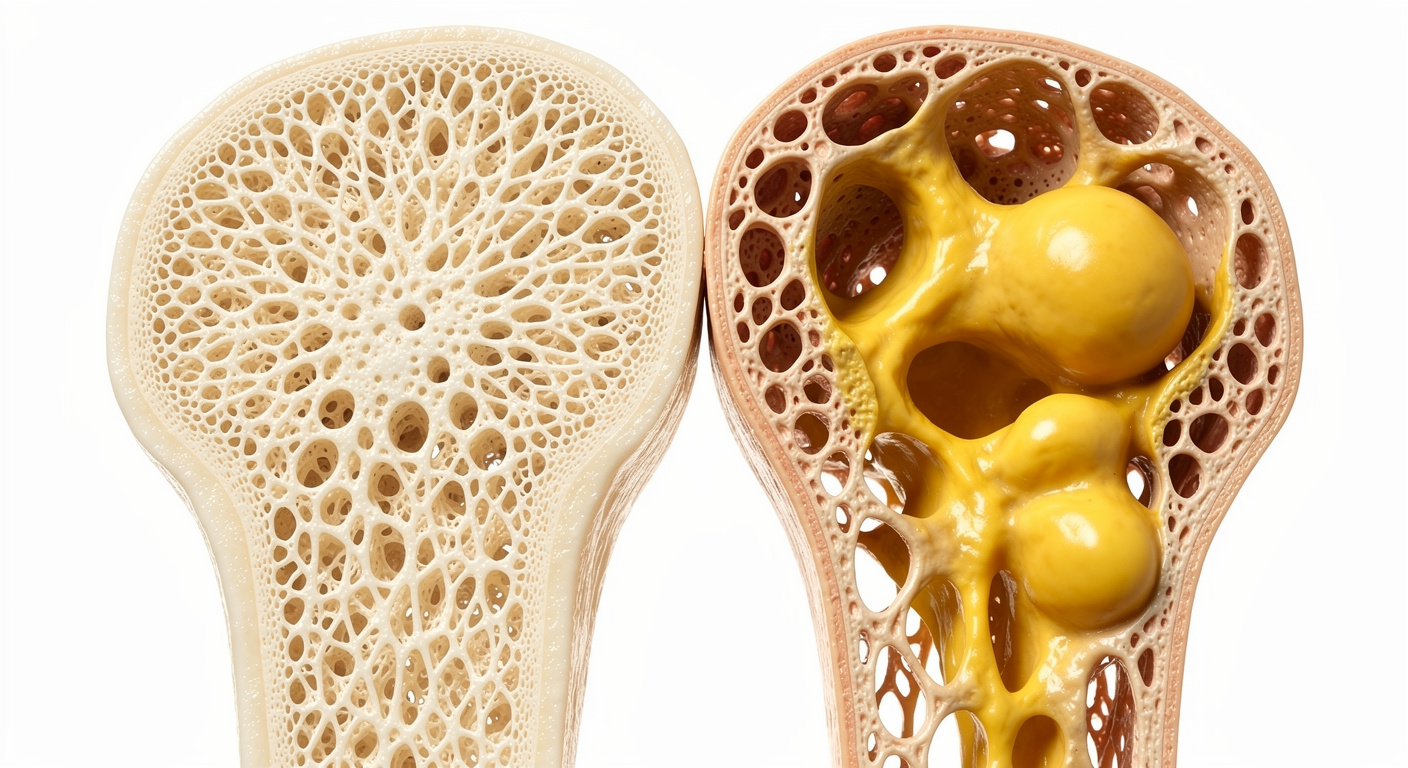
À l’intérieur de nombreux os, la moelle abrite des cellules souches mésenchymateuses. Ce sont des cellules de départ polyvalentes, capables de se différencier soit en tissu osseux, soit en graisse. Le vieillissement naturel tend à influencer ce choix. Lorsque le corps cesse de solliciter son squelette, la balance penche défavorablement : la densité minérale osseuse chute souvent plus rapidement que l’individu ne le perçoit.
Les chercheurs expliquent que ces cellules souches, en l’absence de stimulation mécanique, se mettent à produire davantage de graisse médullaire. Ces poches graisseuses finissent par encombrer l’espace où le nouvel os devrait normalement se former. Cette accumulation rend les os plus poreux au fil du temps, créant un terrain complexe qui complique l’efficacité des traitements médicaux standards.
Le rôle crucial du capteur Piezo1 et l’impact de l’inflammation

L’importance du capteur Piezo1 a été démontrée par des expériences sur des modèles animaux. Le retrait de ce capteur des cellules souches de la moelle chez des souris a entraîné une ossature plus fine et plus faible, accompagnée d’une augmentation parallèle de la graisse médullaire. Même soumises à un entraînement sur tapis roulant, les souris dépourvues de ce capteur n’ont pas bénéficié du renforcement osseux habituel.
En laboratoire, l’activation de cette protéine dans des cellules souches de moelle humaine a permis d’orienter leur développement vers la fabrication d’os plutôt que vers le stockage de graisse. Les résultats lient ainsi directement la force osseuse à la capacité des cellules à sentir la pression à leur surface, et non uniquement à la traction mécanique des muscles sur l’os.
L’étude révèle également qu’en l’absence de ce capteur, les cellules souches émettent des signaux favorisant une inflammation locale. Les données ont permis de tracer ce phénomène jusqu’à la protéine de signalisation Ccl2, qui attire les cellules immunitaires, suivie par la montée d’une seconde molécule, la lipocaline-2. Cette dernière modifie le comportement cellulaire et encourage les programmes de fabrication de graisse. La perte de Piezo1, en amplifiant ces signaux inflammatoires, réduit considérablement la capacité de l’exercice physique à protéger l’os.
Vers des médicaments qui miment l’effort physique

Ces observations ouvrent une voie prometteuse pour le développement pharmaceutique : concevoir un traitement capable d’activer ce même capteur artificiellement. L’idée serait qu’une pilule puisse stimuler Piezo1 dans les cellules souches de la moelle, déclenchant ainsi les mêmes signaux internes que ceux provoqués par une charge physique réelle.
Le professeur Xu Aimin résume cette perspective thérapeutique : « En activant la voie Piezo1, nous pouvons imiter les avantages de l’exercice, trompant ainsi efficacement le corps en lui faisant croire qu’il fait de l’exercice, même en l’absence de mouvement. » Pour prouver le lien de cause à effet, les chercheurs ont utilisé des anticorps pour neutraliser la lipocaline-2 chez les souris, ce qui a eu pour effet de réduire la graisse médullaire et d’augmenter les marqueurs de formation osseuse.
Un autre blocage ciblant la voie Ccl2 a permis de réduire les messages inflammatoires, laissant davantage de cellules souches mûrir en bâtisseurs d’os. Toutefois, les scientifiques avertissent que toute manipulation des signaux immunitaires comporte des risques d’effets secondaires. De plus, comme Piezo1 aide aussi à contrôler les vaisseaux sanguins et d’autres tissus, un futur médicament mimant l’exercice nécessiterait un ciblage extrêmement précis pour être sûr.
Une urgence sanitaire face au vieillissement de la population

La pertinence de ces travaux est soulignée par les statistiques mondiales sur la santé osseuse. Les personnes passant des semaines alitées ou souffrant d’arthrite sévère perdent de la masse osseuse à une vitesse alarmante. L’ostéoporose, qui rend les os cassants, est responsable de fractures chez une femme sur trois et un homme sur cinq de plus de 50 ans.
À Hong Kong, où l’étude a été menée, les chiffres sont particulièrement marquants : le cadre des soins primaires rapporte de l’ostéoporose chez 45 % des femmes et 13 % des hommes âgés de 65 ans et plus. Le professeur Xu Aimin rappelle que cette perte osseuse liée à l’âge affecte des millions de personnes, laissant souvent les patients âgés vulnérables à la perte d’indépendance.
Transformer ces résultats obtenus sur des souris en thérapie humaine nécessitera de prouver l’innocuité du ciblage de ce capteur chez des adultes fragiles. Les chercheurs devront surveiller la densité osseuse et les taux de fracture tout en vérifiant l’absence d’effets néfastes sur le cœur et la circulation sanguine. Si un médicament voit le jour, il ne remplacera pas totalement le mouvement, et les plans de prévention des chutes resteront nécessaires. L’étude complète est publiée dans la revue Signal Transduction and Targeted Therapy.
Selon la source : earth.com
Créé par des humains, assisté par IA.